
為減少鉻渣的危害并從中提取硫酸鈉,設計工藝如下:
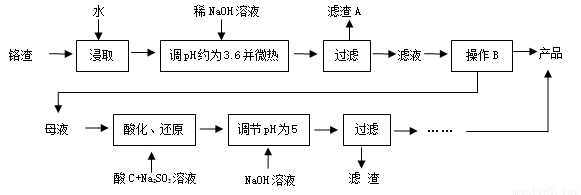
已知:①鉻渣含有Na2SO4及少量Cr2O72-、Fe3+
②Fe3+、Cr3+完全沉淀(c≤1.0×10-5mol·L-1)時pH分別為3.6和5。
(1)“微熱”的作用:① ;② 。
(2)根據(jù)溶解度(S)~溫度(T)曲線,操作B的最佳方法為 (填字母)
a. 蒸發(fā)濃縮,趁熱過濾 b. 蒸發(fā)濃縮,降溫結晶,過濾
(3)酸化后Cr2O72-可被SO32-還原成Cr3+,離子方程式為 ;酸C為 ,Cr(OH)3的溶度積常數(shù)Ksp[Cr(OH)3]= 。
(4)已知Cr(OH)3在溶液中存在平衡H++CrO2-(亮綠色)+H2O?Cr(OH)3(s)?Cr3+(紫色)+3OH-,加入NaOH溶液時要控制pH為5,pH不能過高的理由是 。
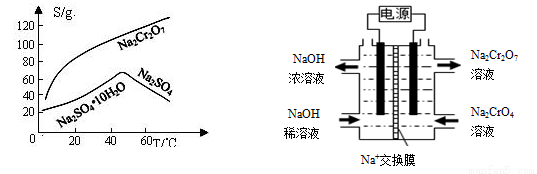
(5)根據(jù)2CrO42-+2H+ Cr2O72-+H2O設計上圖裝置(均為惰性電極)電解Na2CrO4溶液制取Na2Cr2O7,圖中左側電極連接電源的 極,電解制備過程的總反應方程式為 。測定陽極液中Na和Cr的含量,若Na與Cr的物質的量之比為d,則此時Na2CrO4的轉化率為 。若選擇用熔融K2CO3作介質的甲醇(CH3OH)燃料電池充當電源,則負極反應式為 。
Cr2O72-+H2O設計上圖裝置(均為惰性電極)電解Na2CrO4溶液制取Na2Cr2O7,圖中左側電極連接電源的 極,電解制備過程的總反應方程式為 。測定陽極液中Na和Cr的含量,若Na與Cr的物質的量之比為d,則此時Na2CrO4的轉化率為 。若選擇用熔融K2CO3作介質的甲醇(CH3OH)燃料電池充當電源,則負極反應式為 。
科目:高中化學 來源:2015-2016學年湖南省高一下期中化學試卷(解析版) 題型:選擇題
從下列實驗事實得出的結論中,錯誤的是
選項 | 實驗事實 | 結論 |
A | H2可在Cl2中燃燒 | 燃燒不一定有氧氣參加 |
B | 鋁箔在酒精燈火焰上加熱熔化但不滴落 | 氧化鋁熔點高于鋁 |
C | 鈉塊投入水中,迅速熔成銀白色小球 | 鈉的密度比水小 |
D | 某溶液中加入濃NaOH溶液加熱,產生使?jié)駶櫦t色石蕊試紙變藍的氣體 | 原溶液中含NH4+ |
查看答案和解析>>
科目:高中化學 來源:2015-2016學年湖北沙市高二下第四次半月考化學試卷(解析版) 題型:選擇題
下列實驗裝置圖(有些圖中部分夾持儀器未畫出)能達到其實驗目的的是( )
|
|
A.證明酸性:鹽酸>碳酸>苯酚 | B.溴水褪色一定產生了乙烯 |
|
|
C.分離溴乙烷和水 | D. 檢查裝置的氣密性 |
查看答案和解析>>
科目:高中化學 來源:2016屆山西省高三5月月考理綜化學試卷(解析版) 題型:填空題
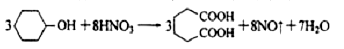
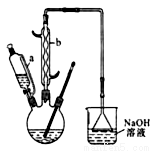
己二酸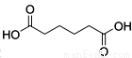 是一種工業(yè)上具有重要意義的有機二元酸,在化工生產、有機合成工業(yè)、醫(yī)藥、潤滑劑制造等方面都有重要作用,能夠發(fā)生成鹽反應、酯化反應等,并能與二元醇縮聚成高分子聚合物等,己二酸產量居所有二元羧酸中的第二位。實驗室合成己二酸的反應原理和實驗裝置示意圖如下:
是一種工業(yè)上具有重要意義的有機二元酸,在化工生產、有機合成工業(yè)、醫(yī)藥、潤滑劑制造等方面都有重要作用,能夠發(fā)生成鹽反應、酯化反應等,并能與二元醇縮聚成高分子聚合物等,己二酸產量居所有二元羧酸中的第二位。實驗室合成己二酸的反應原理和實驗裝置示意圖如下:
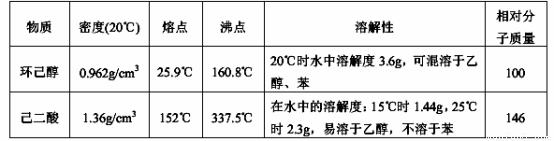
可能用到的有關數(shù)據(jù)如下:
實驗步驟如下:
I、在三口燒瓶中加入16 mL 50%的硝酸(密度為1.31g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4 mL環(huán)己醇。
II、水浴加熱三口燒瓶至50℃左右,移去水浴,緩慢滴加5~6滴環(huán)己醇,搖動三口燒瓶,觀察到有紅棕色氣體放出時再慢慢滴加剩下的環(huán)己醇,維持反應溫度在60℃~65℃之間。
III、當環(huán)己醇全部加入后,將混合物用80℃~90℃水浴加熱約10min(注意控制溫度),直至無紅棕色氣體生成為止。
IV、趁熱將反應液倒入燒杯中,放入冰水浴中冷卻,析出晶體后過濾、洗滌得粗產品。
V、粗產品經提純后稱重為5.7g。
請回答下列問題:
(1) 儀器b的名稱為__________。
(2) 向三口燒瓶中滴加環(huán)己醇時,要控制好環(huán)己醇的滴入速率,防止反應過于劇烈導致溫度迅速上升,否則.可能造成較嚴重的后果,試列舉一條可能產生的后果:____________________。
(3) 已知用NaOH溶液吸收尾氣時發(fā)生的相關反應方程式為:
2NO2+2NaOH=NaNO2+NaNO3+H2O 、NO+NO2+2NaOH =2NaNO2+H2O ;如果改用純堿溶液吸收尾氣時也能發(fā)生類似反應,則相關反應方程式為:____________ _________、___________________。
(4)為了除去可能的雜質和減少產品損失,可分別用冰水和 洗滌晶體。
(5)粗產品可用 法提純(填實驗操作名稱)。本實驗所得到的己二酸產率為 。
查看答案和解析>>
科目:高中化學 來源:2016屆山西省高三5月月考理綜化學試卷(解析版) 題型:選擇題
青蒿素是抗瘧特效藥屬于萜類化合物,如圖所示有機物也屬于萜類化合物,該有機物的一氯取代物有(不含立體異構)
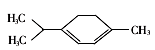
A.5種 B.6種 C.7種 D.8種
查看答案和解析>>
科目:高中化學 來源:2016屆湖北省高三5月高考模擬理綜化學試卷(解析版) 題型:選擇題
已知: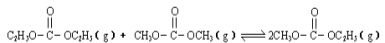 是碳酸甲乙酯的工業(yè)生產原理。下圖是投料比[
是碳酸甲乙酯的工業(yè)生產原理。下圖是投料比[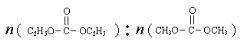 ]分別為3:1和1:1、反應物的總物質的量相同時,
]分別為3:1和1:1、反應物的總物質的量相同時,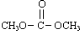 的平衡轉化率與溫度的關系曲線。下列說法正確的是
的平衡轉化率與溫度的關系曲線。下列說法正確的是
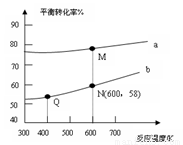
A.曲線b所對應的投料比為3:1
B.M點對應的平衡常數(shù)小于Q點
C.N點對應的平衡混合氣中碳酸甲乙酯的物質的量分數(shù)為0.58
D.M點和Q點對應的平衡混合氣體的總物質的量之比為2:1
查看答案和解析>>
科目:高中化學 來源:2016屆黑龍江省高三考訓練四理綜化學試卷(解析版) 題型:實驗題
綜合利用海水資源是一個重要的研究課題,下面是工業(yè)上用海水制備食鹽、純堿、金屬鎂等物質的一種流程:

完成下列填空
(1)氣體Y是 (填化學式),溶液II中發(fā)生反應的化學方程式是: 。實驗室可用右圖裝置模擬此制備過程,儀器c的名稱 ,反應時a管應通入 。

(2)為了測定碳酸氫鈉中雜質氯元素的含量,先稱取a g試樣用蒸餾水溶解,再用足量稀硝酸酸化,配成100 mL溶液,取出20 mL注入錐形瓶中,然后用c mol/LAgNO3標準溶液滴定Cl-,K2CrO4溶液為指示劑。已知:常溫下Ksp(AgCl)=2×10-10 ,Ksp(Ag2CrO4)=1.12×10-12 ,Ag2CrO4為磚紅色。
①當Cl-恰好沉淀完全即溶液中殘余c(Cl-)=1.0×10-5 mol·L-1,則此時溶液中的c(CrO42-)= mol·L-1。
②滴定過程中,使用棕色滴定管的原因是 ;當觀察到出現(xiàn) 時停止滴定,若此時消耗了AgNO3標準溶液v mL,則碳酸氫鈉樣品中雜質氯元素的質量分數(shù)表達式為 。
③下列情況會造成實驗測定結果偏低的是 。
a.盛放AgNO3溶液的滴定管水洗后未用標準液潤洗
b.滴定管滴定前尖嘴部分有氣泡,滴定后消失
c.滴定前仰視讀數(shù),滴定后俯視讀數(shù)
查看答案和解析>>
科目:高中化學 來源:2015-2016學年四川成都七中高一下課后作業(yè)乙烯化學試卷(解析版) 題型:選擇題
下列物質不可能是乙烯加成產物的是( )
A.CH3CH3 B.CH3CHCl2 C.CH3CH2OH D.CH3CH2Br
查看答案和解析>>
科目:高中化學 來源:2016屆湖北省師大一附高三5月月考理綜化學試卷(解析版) 題型:選擇題
右下表為元素周期表的一部分。X、Y、Z、W為短周期元素,其中X元素的原子最外層電子數(shù)是其內層電子數(shù)的2倍。下列說法正確的是()

A.根據(jù)元素周期律,可以推測存在T3Y4、TZ2和TW4
B.X氫化物的沸點一定比Y氫化物的沸點高
C.XZ2、XW4與YW3都是非極性分子
D.W的氧化物的水化物酸性一定比Z的強
查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com