
青蒿素是抗瘧特效藥屬于萜類化合物,如圖所示有機物也屬于萜類化合物,該有機物的一氯取代物有(不含立體異構)
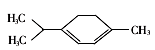
A.5種 B.6種 C.7種 D.8種
 英才點津系列答案
英才點津系列答案 紅果子三級測試卷系列答案
紅果子三級測試卷系列答案 課堂練加測系列答案
課堂練加測系列答案科目:高中化學 來源:2015-2016學年湖南省高一下期中化學試卷(解析版) 題型:選擇題
下列關于鹵族元素的說法正確的是
A.F、Cl、Br、I最高正化合價都為+7
B.鹵族元素的單質只有氧化性
C.從F到I,原子的得電子能力依次減弱
D.鹵素單質與H2化合的難易程度按F2、Cl2、Br2、I2的順序由難變易
查看答案和解析>>
科目:高中化學 來源:2015-2016學年湖北沙市高二下第四次半月考化學試卷(解析版) 題型:選擇題
已知酸性大小:羧酸>碳酸>酚。下列含溴化合物中的溴原子在適當的條件下都能被羥基取代,所得產物能跟NaHCO3溶液反應的是( )
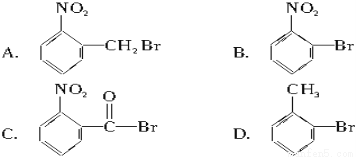
查看答案和解析>>
科目:高中化學 來源:2015-2016學年湖北沙市高二下第四次半月考化學試卷(解析版) 題型:選擇題
下列化學用語的表達正確的是( )
A.原子核內有10個中子的氧原子: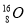
B.二氧化碳的比例模型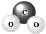
C.Fe3+的最外層電子排布式為:3s23p63d5
D.基態銅原子的外圍電子排布圖為:
查看答案和解析>>
科目:高中化學 來源:2016屆山西省高三5月月考理綜化學試卷(解析版) 題型:選擇題
已知:常溫下濃度為0.1mol/L的下列溶液的pH如表:
溶質 | NaF | Na2CO3 | NaClO | NaHCO3 |
pH | 7.5 | 11.6 | 9.7 | 8.3 |
下列有關說法正確的是( )
A.在相同溫度下,同濃度的三種酸溶液的導電能力順序:H2CO3<HClO<HF
B.等體積等物質的量濃度的NaClO溶液與NaF溶液中離子總數大小:N前<N后
C.若將CO2通入0.1mol/L Na2CO3溶液至溶液中性,則溶液中: 2c(CO32-)+c(HCO3-)= 0.1mol/L
D.向Na2CO3溶液中通入少量的HF氣體,化學反應方程式為: Na2CO3 + 2HF = CO2 + H2O + 2NaF
查看答案和解析>>
科目:高中化學 來源:2016屆湖北省高三5月高考模擬理綜化學試卷(解析版) 題型:實驗題
為減少鉻渣的危害并從中提取硫酸鈉,設計工藝如下:
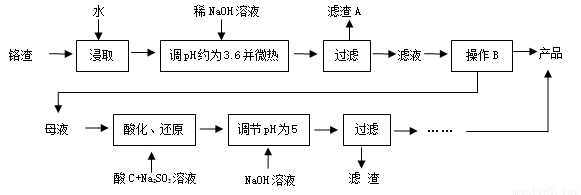
已知:①鉻渣含有Na2SO4及少量Cr2O72-、Fe3+
②Fe3+、Cr3+完全沉淀(c≤1.0×10-5mol·L-1)時pH分別為3.6和5。
(1)“微熱”的作用:① ;② 。
(2)根據溶解度(S)~溫度(T)曲線,操作B的最佳方法為 (填字母)
a. 蒸發濃縮,趁熱過濾 b. 蒸發濃縮,降溫結晶,過濾
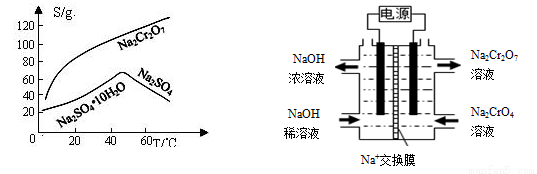
(3)酸化后Cr2O72-可被SO32-還原成Cr3+,離子方程式為 ;酸C為 ,Cr(OH)3的溶度積常數Ksp[Cr(OH)3]= 。
(4)已知Cr(OH)3在溶液中存在平衡H++CrO2-(亮綠色)+H2O?Cr(OH)3(s)?Cr3+(紫色)+3OH-,加入NaOH溶液時要控制pH為5,pH不能過高的理由是 。
(5)根據2CrO42-+2H+ Cr2O72-+H2O設計上圖裝置(均為惰性電極)電解Na2CrO4溶液制取Na2Cr2O7,圖中左側電極連接電源的 極,電解制備過程的總反應方程式為 。測定陽極液中Na和Cr的含量,若Na與Cr的物質的量之比為d,則此時Na2CrO4的轉化率為 。若選擇用熔融K2CO3作介質的甲醇(CH3OH)燃料電池充當電源,則負極反應式為 。
Cr2O72-+H2O設計上圖裝置(均為惰性電極)電解Na2CrO4溶液制取Na2Cr2O7,圖中左側電極連接電源的 極,電解制備過程的總反應方程式為 。測定陽極液中Na和Cr的含量,若Na與Cr的物質的量之比為d,則此時Na2CrO4的轉化率為 。若選擇用熔融K2CO3作介質的甲醇(CH3OH)燃料電池充當電源,則負極反應式為 。
查看答案和解析>>
科目:高中化學 來源:2016屆湖北省高三5月高考模擬理綜化學試卷(解析版) 題型:選擇題
第三周期元素,濃度均為0.01 mol/L的最高價氧化物對應水化物的pH與原子半徑的關系如右圖所示。則下列說法正確的是

A.氣態氫化物的穩定性:N>R
B.Z的最高價氧化物對應的水化物能溶于稀氨水
C.Y和R形成的化合物既含離子鍵又含共價鍵
D.X和M兩者最高價氧化物對應的水化物恰好完全反應后溶液的pH>7
查看答案和解析>>
科目:高中化學 來源:2015-2016學年四川成都七中高一下課后作業乙烯化學試卷(解析版) 題型:實驗題
下面是石蠟油在熾熱碎瓷片的作用下產生C2H4并檢驗C2H4性質的實驗,完成下列各小題。

(1)碎瓷片的作用是_____________。
(2)B中現象是________,乙烯發生_______反應。
(3)C中現象是________,發生反應的化學方程式______________________。
(4)在D處點燃時必須進行的操作是___________________________。
查看答案和解析>>
科目:高中化學 來源:2016屆湖北省師大一附高三5月月考理綜化學試卷(解析版) 題型:實驗題
硫酸亞鐵晶體(FeSO4· 7H2O)俗稱綠礬,加熱至高溫會分解。某化學研究小組利用下列裝置探究FeSO4分解后的產物。
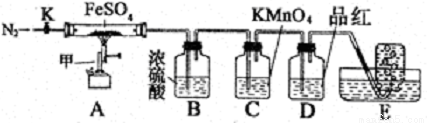
實驗步驟:
按圖組裝好儀器(已省略夾持儀器)并檢查裝置的氣密性,準確稱取mgFeSO4固體置于硬質玻璃管中,將E中的導管撤出水槽,打開活塞K,通入一段時間的N2,關閉活塞K。加熱A中的玻璃管一段時間后,將E中導管置于水槽集氣瓶口收集產生的,用帶火星的木條檢驗E中所收集的氣體,帶火星的木條能夠復燃。待A中固體不再分解后,停止加熱,打開K,緩慢通入氮氣至玻璃管冷卻,得到紅棕色粉末。請回答下列問題:
(1)儀器甲的名稱是__________;
(2)B中濃硫酸的作用__________。
(3)實驗過程中發現C中溶液顏色變淺,D中無明顯變化。寫出C中發生反應的離子方程式__________;
(4) FeSO4完全分解后,還需要通入一段時間N2的原因是__________。
(5)若C中原先加入了20mL 1.00mol/L的KMnO4溶液,為了確定FeSO4分解的化學方程式,某同學進行了如下實驗:
Ⅰ、稱量B裝置在實驗前后增重 0.80g;
Ⅱ、將實驗后C中的溶液全部轉移至100mL容量瓶中,并加水稀釋至刻度線;
Ⅲ、準確量取20.00mL溶液至錐形瓶中,加入足量稀硫酸酸化,用0.20mo1/L標準H2C2O4溶液滴定至終點:
Ⅳ、重復實驗3次.記錄數據如下:
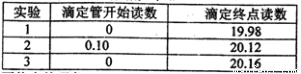
①滴定至終點的現象__________。
②FeSO4分解的化學方程式為__________。
(6)請設計一個實驗來檢驗A中的FeSO4是否完全分解__________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com