
【題目】硝酸鈣晶體[Ca(NO3)2·4H2O]常用于電子、儀表及冶金工業。一種利用CaO制備Ca(NO3)2·4H2O的流程如下:

(1)“制漿”過程中發生反應的化學方程式是__。
(2)“氣體X”的化學式是___。
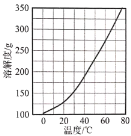
(3)Ca(NO3)2·4H2O的溶解度隨溫度變化的曲線如圖所示。“酸化”后制取Ca(NO3)2·4H2O的操作主要包括加熱濃縮、__、過濾、洗滌、干燥。實驗室過濾操作必須用到的玻璃儀器有燒杯、玻璃棒和__。
科目:高中化學 來源: 題型:
【題目】甲醇是一種重要的化工原料,又是一種可再生能源,具有開發和應用的廣闊 前景。
前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g) △H=+84kJmol1,
2H2(g)+O2(g)═2H2O(g) △H=484kJmol1
工業上常以甲醇為原料制取甲醛,請寫出CH3OH(g)與O2(g)反應生成HCHO(g)和H2O(g)的熱化學方程式:________________________________________________________________________
(2)在一容積為2L的密閉容器內,充入0.2molCO與0.4molH2發生反應CO(g)+2H2(g)![]() CH3OH(g)。 CO的平衡轉化率與溫度,壓強的關系如圖所示。
CH3OH(g)。 CO的平衡轉化率與溫度,壓強的關系如圖所示。
①A,B兩點對應的壓強大小關系是PA________PB(填“>,<,=”)
②下列敘述能說明上述反應能達到化學平衡狀態的是___________(填代號)
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的體積分數不再改變
c.混合氣體的密度不再改變 d.氣體的平均相對分子質量和壓強不再改變
③在P1壓強、T1°C時,該反應的平衡常數K=_________(填計算結果)
④T1°C、1L的密閉容器內發生上述反應,測得某時刻各物質的物質的量如下:CO:0.1mol, H2 :0.2mol, CH3OH:0.2mol。此時v正 ________ v逆(填> 、 < 或 =)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】《本草圖經》有“白礬多人藥用”。白礬[KAl(SO4)2·12H2O]又稱明礬.鉀鋁礬、鉀明礬等,是一種重要的化學試劑。下列說法正確的是( )
A.含白礬的藥物不宜與胃藥奧美拉唑碳酸氫鈉膠囊同時服用
B.0.1molL-1白礬溶液完全水解生成Al(OH)3膠粒數小于6.02×1022
C.向含0.1mol白礬的溶液中滴入Ba(OH)2溶液,若SO42-和Al3+全部轉化為BaSO4和Al(OH)3沉淀,則此時生成沉淀的質量最大
D.室溫下,0.1molL-1白礬溶液中水電離出c(H+)小于10-7mol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿佛加德羅常數,下列說法中正確的是( )
A.0.1mol鈉和O2在一定條件下反應生成Na2O和Na2O2混合物時,失去電子數為0.1NA
B.0.1mol鐵和O2在一定條件下生成FeO和Fe2O3混合物時,失去電子數為0.2NA
C.標況下,1L乙醇完全燃燒時產生CO2的分子數為![]()
D.通常狀態下,32克O2含氧原子數為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:工業合成氨的反應為N2(g)+3H2(g)![]() 2NH3(g) △H<0。下列事實不能用勒夏特列原理解釋的是( )
2NH3(g) △H<0。下列事實不能用勒夏特列原理解釋的是( )
A.溫度過高對合成氨不利
B.合成氨在高壓下進行是有利的
C.高溫及加入催化劑都能使合成氨的反應速率加快
D.增加N2的濃度可提高平衡混合物中NH3的產量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學用如圖所示裝置探究原電池的工作原理,并推出下列結論,其中不正確的是( )
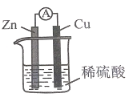
A.鋅片不斷溶解,說明Zn失去電子
B.銅片上產生氣泡,說明溶液中H+在其表面得到電子
C.電流計指針發生偏轉,說明該裝置將電能轉換為化學能
D.該裝置中發生的總反應為Zn+H2SO4=ZnSO4+H2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】分析下表中的四個熱化學方程式,判斷氫氣和丙烷的標準燃燒熱分別是
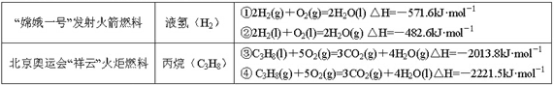
A.-571.6 kJ·mol-1,-2221.5 kJ·mol-1B.-285.5 kJ·mol-1,-2013.8 kJ·mol-1
C.-285.8 kJ·mol-1,-2221.5 kJ·mol-1D.-241.3 kJ·mol-1,-2013.8 kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用下列四種裝置制備和收集Cl2:
A. 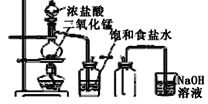 B.
B. 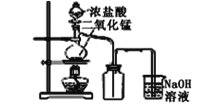
C. 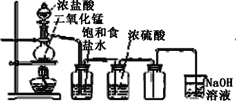 D.
D. 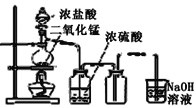
將收集到Cl2置于天平上稱量,若四個集氣瓶體積相同、質量相等,則稱量結果是( )
A.A最重B.B最重C.C最重D.D最重
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com