
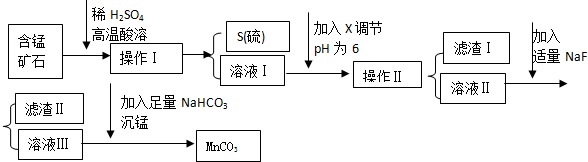
| 物質 | 開始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Ca(OH)2 | 12 | ------ |
| Al(OH)3 | 3.8 | 4.7 |
分析 錳礦石的主要成分是MnO2還含CaO、Al2O3、FeS等雜質,加入稀硫酸高溫酸溶,二氧化錳將氯化亞鐵氧化成硫單質、鐵離子,同時氧化鈣和氧化鋁與稀硫酸反應,通過操作Ⅰ過濾得到S沉淀和含有錳離子、鐵離子、鈣離子和鋁離子的濾液Ⅰ;通過調節濾液Ⅰ的pH,將鋁離子、鐵離子轉化成Al(OH)3、Fe(OH)3,過濾后分離出Al(OH)3、Fe(OH)3,濾液Ⅱ中含有鈣離子和錳離子,加入NaF后將鈣離子轉化成CaF2沉淀,過濾后得到濾渣Ⅱ(CaF2沉淀)和濾液Ⅲ(主要含有硫酸錳),再加入碳酸氫鈉,發生反應:MnSO4+2NaHCO3=MnCO3↓+Na2SO4+H2O+CO2↑,從而獲得MnCO3,
(1)操作Ⅰ得到的是S單質的沉淀,據此判斷分離方法;
(2)溶液Ⅰ加入KSCN溶液呈現紅色,說明有鐵離子存在,據此寫出在酸溶過程中FeS發生反應的離子方程式;
(3)除雜時由于不能引進雜質,則調節溶液的pH所用的物質最好為MnCO3;
(4)根據表中數據分析可得到當pH=6的時候,鐵離子和鋁離子會完全沉淀,據此可知濾渣成分;濾液中還會含有鈣離子,加入NaF后轉化成CaF2沉淀;
(5)沉錳是利用碳酸氫鈉與硫酸錳反應生成碳酸錳沉淀,據此寫出反應的化學方程式;
(6)MnCO3也是制造鋰離子電池的重要原料,在此電池充電過程中正極發生LiMn2O4失去電子寫生成Li1-xMn2O4,據此寫出該電池充電時正極發生的反應式.
解答 解:錳礦石的主要成分是MnO2還含CaO、Al2O3、FeS等雜質,加入稀硫酸高溫酸溶,二氧化錳將氯化亞鐵氧化成硫單質、鐵離子,同時氧化鈣和氧化鋁與稀硫酸反應,通過操作Ⅰ過濾得到S沉淀和含有錳離子、鐵離子、鈣離子和鋁離子的濾液Ⅰ;通過調節濾液Ⅰ的pH,將鋁離子、鐵離子轉化成Al(OH)3、Fe(OH)3,過濾后分離出Al(OH)3、Fe(OH)3,濾液Ⅱ中含有鈣離子和錳離子,加入NaF后將鈣離子轉化成CaF2沉淀,過濾后得到濾渣Ⅱ(CaF2沉淀)和濾液Ⅲ(主要含有硫酸錳),再加入碳酸氫鈉,發生反應:MnSO4+2NaHCO3=MnCO3↓+Na2SO4+H2O+CO2↑,從而獲得MnCO3,
(1)操作Ⅰ得到的是S單質的沉淀,該物質分離的方法為過濾,
故答案為:過濾;
(2)取溶液Ⅰ加入KSCN溶液,溶液呈現紅色,說明有鐵離子存在,所以在酸溶過程中FeS發生反應的離子方程式:FeS+12H++3MnO2$\frac{\underline{\;高溫\;}}{\;}$2Fe3++2S↓+3Mn2++6H2O,
故答案為:FeS+12H++3MnO2$\frac{\underline{\;高溫\;}}{\;}$2Fe3++2S↓+3Mn2++6H2O;
(3)由于不能引進雜質,則調節溶液的pH所用的物質X最好為MnCO3固體,故C正確,
故答案為:C;
(4)根據表中數據分析可得到當pH=6的時候,鐵離子和鋁離子會完全沉淀,因此濾渣為Al(OH)3、Fe(OH)3;
濾液中還會含有鈣離子,則加入NaF后轉化成CaF2沉淀,
故答案為:Al(OH)3、Fe(OH)3;CaF2;
(5)濾液Ⅲ中含有硫酸錳,硫酸錳與碳酸氫鈉溶液反應生成碳酸錳沉淀、硫酸鈉、二氧化碳和水,反應的化學方程式為:MnSO4+2NaHCO3=MnCO3↓+Na2SO4+H2O+CO2↑,
故答案為:MnSO4+2NaHCO3=MnCO3↓+Na2SO4+H2O+CO2↑;
(6)MnCO3也是制造鋰離子電池的重要原料,在此電池充電過程中正極發生LiMn2O4失去電子的氧化反應,該電池充電時正極發生的反應式為:LiMn2O4-xe-=Li1-xMn2O4+xLi+,
故答案為:LiMn2O4-xe-=Li1-xMn2O4+xLi+.
點評 本題考查了制備方案的設計,題目難度中等,根據制備流程明確實驗目的、制備原理為解答關鍵,注意掌握化學實驗基本操作方法,試題有利于提高學生的分析、理解能力及化學實驗能力.


科目:高中化學 來源: 題型:選擇題
| A. | 氫化物的通式為 RH5 | B. | 最高化合價是+5 價 | ||
| C. | 非金屬性由上到下遞增 | D. | 其最高價含氧酸均為強酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SO2具有氧化性,可用于漂白紙漿 | B. | NH4HCO3含有氮元素,可用作氮肥 | ||
| C. | Fe2(SO4)3易溶于水,可用作凈水劑 | D. | Al2O3硬度大,可用作耐高溫材料 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 稀硫酸滴在銅片上:Cu+2H+═Cu2++H2 | |
| B. | 氧化銅與硫酸反應:O2-+2 H+═H2O | |
| C. | 硫酸鈉和氯化鋇兩種溶液混合:Ba2++SO42-═BaSO4↓ | |
| D. | 鹽酸與石灰石反應:CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 同時含有分子和離子的電解質溶液,一定是弱電解質溶液 | |
| B. | pH=3的鹽酸中,其c(H+)是pH=1的鹽酸中的3倍 | |
| C. | 0.1 mol/L KOH溶液和0.1 mol/L 氨水中,其c(OH-)相等 | |
| D. | 室溫時,pH=3的硫酸和pH=11的氨水等體積混合,混合溶液的pH>7 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 元素代號 | A | B | C | D | E |
| 原子半徑/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合價 | +2 | +3 | +6、-2 | -1 | -2 |
 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com