
| A. | 某溶液中由水電離出的c(H+)=1×10-a mol/L,若a>7時,該溶液pH一定為14-a | |
| B. | 等體積、等物質(zhì)的量濃度的Na2CO3溶液與NaHCO3溶液混合:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| C. | 將0.2 mol/L的某一元酸HA溶液和0.1 mol/L NaOH溶液等體積混合后溶液pH大于7,則反應(yīng)后的混合液:c(HA)>c(Na+)>c(A-) | |
| D. | pH=3的二元弱酸H2R溶液與pH=11的NaOH溶液混合后,混合液的pH等于7,則反應(yīng)后的混合液:2c(R2-)+c(HR-)>c(Na+) |
分析 A.溶液中由水電離出的c(H+)=1×10-a mol/L,若a>7時,說明水電離被抑制,溶液中溶質(zhì)可能是酸或堿;
B.任何電解質(zhì)溶液中都存在物料守恒,根據(jù)物料守恒判斷;
C.將0.2 mol/L的某一元酸HA溶液和0.1 mol/L NaOH溶液等體積混合后,溶液中溶質(zhì)為等物質(zhì)的量濃度的NaA和HA,溶液pH大于7,說明NaA水解程度大于HA電離程度;
D.pH=3的二元弱酸H2R溶液與pH=11的NaOH溶液混合后,混合液的pH等于7,則混合溶液中c(OH-)=c(H+),結(jié)合電荷守恒判斷.
解答 解:A.溶液中由水電離出的c(H+)=1×10-a mol/L,若a>7時,說明水電離被抑制,溶液中溶質(zhì)可能是酸或堿,如果是酸,溶液的pH=14-a,如果是堿,溶液的pH=a,故A錯誤;
B.任何電解質(zhì)溶液中都存在物料守恒,根據(jù)物料守恒得2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)],故B錯誤;
C.將0.2 mol/L的某一元酸HA溶液和0.1 mol/L NaOH溶液等體積混合后,溶液中溶質(zhì)為等物質(zhì)的量濃度的NaA和HA,溶液pH大于7,說明NaA水解程度大于HA電離程度,則溶液中存在c(HA)>c(Na+)>c(A-),故C正確;
D.pH=3的二元弱酸H2R溶液與pH=11的NaOH溶液混合后,混合液的pH等于7,則混合溶液中c(OH-)=c(H+),結(jié)合電荷守恒得2c(R2-)+c(HR-)=c(Na+),故D錯誤;
故選C.
點評 本題考查離子濃度大小比較,為高頻考點,側(cè)重考查學(xué)生分析判斷能力,明確混合溶液中溶質(zhì)成分及其性質(zhì)是解本題關(guān)鍵,注意結(jié)合溶液酸堿性判斷離子濃度大小,會靈活運(yùn)用電荷守恒和物料守恒,易錯選項是B,注意:電荷守恒和物料守恒與溶液中溶質(zhì)種類多少無關(guān).



| 年級 | 高中課程 | 年級 | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來源: 題型:選擇題
| 選項 | 實驗事實 | 結(jié)論 |
| A | 其他條件相同,Na2S2O3溶液濃度越大,與同濃度的硫酸反應(yīng)析出流沉淀所需的時間越短 | 當(dāng)其他條件不變時,增大反應(yīng)物濃度,化學(xué)反應(yīng)速率增大 |
| B | 用銅作電極電解CuSO4溶液,CuSO4溶液濃度不變 | Cu2+沒有參與電極反應(yīng) |
| C | 在常溫下N2不能與O2反應(yīng),而白磷卻能自燃 | 氮元素的非金屬性比磷元素的弱 |
| D | 醋酸能與堿反應(yīng) | 醋酸分子一定不能存在于堿性溶液中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:解答題
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學(xué) 來源: 題型:多選題
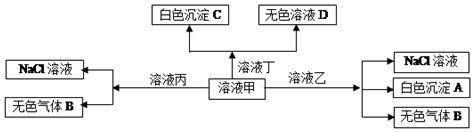
| A. | 在甲中滴加丁開始反應(yīng)的離子方程式:HCO${\;}_{3}^{-}$+Ba2++OH-=BaCO3↓+H2O | |
| B. | 溶液丙中還可以大量共存的離子有:Fe2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | |
| C. | 白色沉淀A可能溶解在溶液D中 | |
| D. | 甲為NaHCO3,乙為AlCl3 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:選擇題
| A. | 氫氧化鈉溶液 | B. | 澄清石灰水 | C. | 2 mol/L 鹽酸 | D. | 2 mol/L 硫酸 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:選擇題
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:選擇題
| A. | pH=3的強(qiáng)酸溶液1 mL,加水稀釋至100 mL后,溶液pH降低2個單位 | |
| B. | 1 L 0.50 mol/L NH4Cl 溶液與2 L 0.25 mol/L NH4Cl 溶液含NH4+ 物質(zhì)的量后者大 | |
| C. | 誤將鋇鹽(主要為BaCl2)當(dāng)作食鹽食用時,常用0.5%的Na2SO4溶液解毒;溶洞、珊瑚的形成;泡沫滅火器“泡沫”產(chǎn)生的原理均可用沉淀溶解平衡原理來解釋 | |
| D. | pH=4、濃度均為0.1 mol•L-1 的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)-c(CH3COOH)=2×(10-4-10-10)mol/L |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:解答題
 25℃時,電離平衡常數(shù):
25℃時,電離平衡常數(shù):| 弱酸的化學(xué)式 | CH3COOH | HClO | H2CO3 |
| 電離平衡常數(shù) (25℃) | 1.8×10-5 | 3.0×10-8 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com