
| A. | 向氨水中加水可使溶液中n(H+)和n(OH-)均增大 | |
| B. | 若Na2A、Na2B溶液的pH分別為8和9,則酸性一定是H2A>H2B | |
| C. | 已知室溫時,0.1mol•1-1某一元酸HA的電離平衡常數為1×10-7,則該酸的電離度約為0.1% | |
| D. | 新制氯水中:c(H+)>c(Cl-)>c(CLO-)>c(OH-) |
分析 A、氨水中存在電離平衡NH3•H2O?NH4++OH-,加水促進氨水的電離;
B、Na2A、Na2B溶液的濃度沒有說明無法判斷H2A,H2B的酸性強弱;
C、電離平衡常數=$\frac{c({A}^{-}).c({H}^{+})}{c(HA)}$=1×10-2,則c(H+)=$\sqrt{1{0}^{-7}×0.1}$=10-4mol/L,電離度=$\frac{c(HA)(電離)}{c(HA)(總)}$×100%;
D、氯水中存在HCl和HClO,HCl完全電離,HClO部分電離.
解答 解:A、氨水中存在電離平衡NH3•H2O?NH4++OH-,加水促進氨水的電離,電離平衡向正方向移動,n(H+)和n(OH-)均增大,故A正確;
B、Na2A、Na2B溶液的濃度沒有說明無法判斷H2A,H2B的酸性強弱,故B錯誤;
C、電離平衡常數=$\frac{c({A}^{-}).c({H}^{+})}{c(HA)}$=1×10-7,則c(H+)=$\sqrt{1{0}^{-7}×0.1}$=10-4mol/L,電離度=$\frac{c(HA)(電離)}{c(HA)(總)}$×100%=$\frac{1{0}^{-4}mol/L}{0.1mol/L}$=0.1%,故C正確;
D、氯水中存在HCl和HClO,HCl完全電離,HClO部分電離,所以溶液:c(H+)>c(Cl-)>c(CLO-)>c(OH-),故D正確.
故選B.
點評 本題考查了電離平衡移動的影響因素、電解質溶液中離子濃度大小比較、離子積常數的計算應用和溶液PH計算分析,掌握基礎是關鍵,題目較簡單.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 一定含有Mg2+、Al3+、Clˉ,不含Na+、NH4+ | |
| B. | 一定含有Na+、Mg2+、Clˉ,不含NH4+,可能含有Al3+ | |
| C. | c(Clˉ)為 4.00mol•L-1,c(Al3+)為1.00 mol•L-1 | |
| D. | c(Mg2+)為 1.00mol•L-1,c(Na+)為 0.50 mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | LiH與D2O反應,所得氫氣的摩爾質量為4g/mol | |
| B. | 1mol LiAlH4在125℃完全分解,轉移3mol電子 | |
| C. | LiH與水反應的化學方程式為:LiH+H2O=LiOH+H2↑ | |
| D. | LiH與中微粒半徑r(Li+)>r(H-) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 第一電離能大小:S>P>Si | |
| B. | 電負性順序:C<N<O<F | |
| C. | 因為晶格能CaO比KCl高,所以KCl比CaO熔點高 | |
| D. | SO2與CO2化學性質類似,分子結構也都呈直線型,相同條件下SO2的溶解度更大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 0℃ | 50℃ | 80℃ | |
| Ca(OH)2 | 0.173g | 0.13g | 0.094g |
| Ba(OH)2•8H2O | 1.64g | 13.2g | 101.4g |
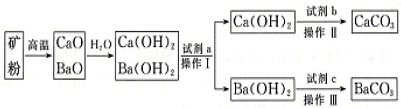
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 時間/min | CO | H2O(g) | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | C1 |
| 6 | 0.096 | 0.266 | 0.104 | C2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,48gO2和O3含有的氧原子數均為3NA5.4g鋁與足量NaOH反應轉移的電子數為0.3NA | |
| B. | 12g重水(D2O)中含有的電子數為6 NA | |
| C. | 標準狀況下,11.2L苯所含原子數為6NA | |
| D. | 160g膽礬溶于水形成1L溶液,溶液的物質的量濃度為1mol/L |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com