
下列有關儀器的使用方法或實驗操作正確的是
A、做金屬鈉與水反應實驗時,剩余的鈉不能再放入原試劑瓶
B、酸式滴定管裝標準液前,必須先用該溶液潤洗
C、錐形瓶用作反應容器時一定不能加熱
D、用容量瓶配溶液時,若加水超過刻度線,立即用滴定管吸出多余液體。
科目:高中化學 來源:2014-2015學年廣東省佛山市高三上學期第一次月考化學試卷(解析版) 題型:選擇題
下列離子方程式書寫正確的是
A.將少量的H2S氣體通入硫酸銅溶液中: H2S+Cu2+=CuS↓+2H+
B.將NO2氣體通入水中:2NO2+H2O= NO3-+ NO↑+2H+
C.ICl 和Cl2的化學性質相似,將ICl通入KOH溶液中:ICl+2OH-= I-+ ClO-+H2O
D.往100ml 1.5mol/L的FeBr2 溶液中通入0.15mol Cl2:2Br-+Cl2=Br2+2Cl-
查看答案和解析>>
科目:高中化學 來源:2016屆貴州省貴陽市高三8月摸底考試化學試卷(解析版) 題型:填空題
(10分)請根據表中數據回答有關問題:
酸或堿 | 電離常數(Ka或Kb) | 難(微)溶物 | 溶度積常數 |
CH3COOH | 1.8×10-5 | BaSO4 | 1×10-10 |
HNO2 | 4.6×10-4 | BaCO3 | 2.6×10-9 |
HCN | 5×10-10 | CaSO4 | 7×10-5 |
HClO | 3×10-8 | ||
NH3·H2O | 1.8×10-5 |
(1)表中所列四種酸中,酸性最弱的是 (用化學式表示)。下列能使醋酸溶液中CH3 COOH的電離度增大,而電離常數不變的操作是 (填序號);
A.升高溫度 B.加水稀釋
C.加少量的CH3 COONa固體 D.加少量冰醋酸
(2)已知純水在100℃時的pH=6。該溫度下0. lmol/L的NaOH溶液中,pH為 ;
(3)常溫下,向水中加入少量醋酸銨固體,所得溶液呈中性,簡述其原因 ;
(4)工業中制BaCl2時,需先將BaSO4轉化為BaCO3。現有足量的BaSO4懸濁液,在該懸濁液中加純堿粉末并不斷攪拌,欲使SO42-物質的量濃度達到0.01 mol/L以上,則溶液中CO32-物質的量濃度應≥_______mol/L;
查看答案和解析>>
科目:高中化學 來源:2015-2016學年安徽省合肥市高二上開學考試化學試卷(解析版) 題型:選擇題
已知鋇的金屬活動性處于鉀和鈉之間。則下列變化中可能實現的是
A.鋇可從氯化鈉溶液中置換出金屬鈉
B.鋇可從冷水中置換出氫氣
C.鋇可從硫酸銅溶液中置換出銅
D.在溶液中Ba2+可氧化金屬鋅,生成Zn2+
查看答案和解析>>
科目:高中化學 來源:2016屆安徽省等六校教研會高三第一次聯考化學試卷(解析版) 題型:選擇題
LiOH是制備鋰離子電池的材料,可由電解法制備。工業上利用如圖裝置電解制備LiOH,兩電極區電解液分別為LiOH和LiCl溶液。下列說法正確的是
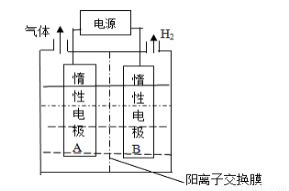
A、B極區電解液為LiOH溶液
B、電極每產生22.4L氣體,電路中轉移2mole-
C、電解過程中Li+遷移入B電極區、OH-遷移入A電極區
D、電解池中總反應方程式為:2HCl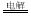 2H2↑+Cl2↑
2H2↑+Cl2↑
查看答案和解析>>
科目:高中化學 來源:2016屆廣東省高三第一次月考理綜化學試卷(解析版) 題型:選擇題
下列離子方程式正確的是
A.澄清石灰水與稀鹽酸反應:Ca(OH)2 + 2H+ =Ca2+ + 2H20
B.碳酸鈉溶液與少量鹽酸反應:CO32- + 2H+= H2O + CO2↑
C.稀硫酸與氫氧化鋇溶液反應 :H+ + OH- +Ba2+ +SO42-=H2O + BaSO4↓
D.氫氧化銅與稀硫酸反應 :Cu(OH)2 + 2H+= Cu2+ +2H2O
查看答案和解析>>
科目:高中化學 來源:2016屆湖北省高三普通班8月月考化學試卷(解析版) 題型:選擇題
A由Al2O3、Fe3O4、Al、Cu中的某幾種粉末混合而成,設計成份分析方案如下: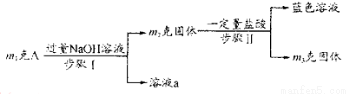
下列分析不正確的是
A.當m1>m2時,溶液a中陰離子只有1種
B.生成藍色溶液的離子方程式為: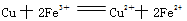
C.要確定混合物中是否含A1,可取A加入適量稀HC1
D.當m2-m3=2.96g,Fe3O4的質量至少為2.32 g
查看答案和解析>>
科目:高中化學 來源:2016屆江西省高三上學期第一次月考化學試卷(解析版) 題型:選擇題
依照阿伏加德羅定律,下列敘述正確的是
A.同溫同壓下兩種氣體的體積之比等于摩爾質量之比
B.同溫同壓下兩種氣體的物質的量之比等于密度反比
C.同溫同壓下兩種氣體的摩爾質量之比等于密度反比
D.同溫同體積下兩種氣體的物質的量之比等于壓強之比
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com