
 用下面兩種方祛可以制得白色的Fe(OH)2沉淀.
用下面兩種方祛可以制得白色的Fe(OH)2沉淀.分析 (1)用鐵與稀硫酸反應可制得FeSO4溶液;
(2)根據氫氧化亞鐵極易被空氣中的氧氣氧化成氫氧化鐵分析;
(3)同(1);
(4)生成的氫氣使裝置Ι中壓強變大,使Ι中的藥品硫酸亞鐵進入Ⅱ中,與Ⅱ中的藥品氫氧化鈉反應得到氫氧化亞鐵;
(5)氫氣充滿試管I和試管II,且空氣不易進入裝置.
解答 解:(1)鐵與稀硫酸反應生成硫酸亞鐵和氫氣,可制得FeSO4溶液;
故答案為:稀H2SO4、鐵屑;
(2)為避免生成的Fe(OH)2沉淀接觸O2,可用長滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再擠出NaOH溶液方可達到目的;
故答案為:避免生成的Fe(OH)2沉淀接觸O2;
(3)在試管I里加入試劑稀H2SO4、鐵屑,獲得硫酸亞鐵溶液;
故答案為:稀H2SO4、鐵屑;
(4)試管I里加入試劑稀H2SO4、鐵屑,獲得硫酸亞鐵溶液,并能產生氫氣,當氫氣使裝置Ι中壓強變大,使Ι中的藥品硫酸亞鐵進入Ⅱ中,與Ⅱ中的藥品氫氧化鈉反應得到氫氧化亞鐵,發生的離子方程式為:Fe2++2OH-=Fe(OH)2↓;
故答案為:NaOH溶液;Fe2++2OH-=Fe(OH)2↓;
(5)試管Ⅰ中反應生成的H2充滿了試管I和試管Ⅱ,且外界空氣不容易進入,這樣獲得的氫氧化亞鐵可以不被氧氣氧化而變質;
故答案為:試管Ⅰ中反應生成的H2充滿了試管I和試管Ⅱ,且外界空氣不容易進入.
點評 獲得氫氧化亞鐵隔絕空氣是關鍵,要求學生學會看圖,能看懂題目中所給的裝置圖,每一部分的作用,只有這樣才能明確反應是怎么進行的.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:實驗題
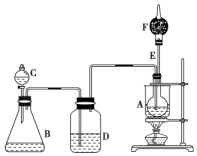 已知CH3CH2OH+NaBr+H2SO4CH3CH2Br+NaHSO4+H2O,如圖是某校化學課外活動小組設計的乙醇與氫鹵酸反應的實驗裝置圖.
已知CH3CH2OH+NaBr+H2SO4CH3CH2Br+NaHSO4+H2O,如圖是某校化學課外活動小組設計的乙醇與氫鹵酸反應的實驗裝置圖.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 在有機物分子中碳原子所連的4個原子或原子團均不相同時,該碳原子叫手性碳原子,含有手性碳原子的有機物具有光學活性,下邊有機物含有一個手性碳原子(*C表示手性碳原子),具有光學活性.若要消除其光學活性,可選用下列哪些化學反應( )
在有機物分子中碳原子所連的4個原子或原子團均不相同時,該碳原子叫手性碳原子,含有手性碳原子的有機物具有光學活性,下邊有機物含有一個手性碳原子(*C表示手性碳原子),具有光學活性.若要消除其光學活性,可選用下列哪些化學反應( )| A. | 只有①②③ | B. | 只有④⑤⑥ | C. | 只有①②④⑤⑥ | D. | 以上都可以 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 再通入1molO2,平衡正向移動,平衡常數不變 | |
| B. | 降低溫度,正反應速率先減小后增大 | |
| C. | 平衡時SO2氣體的轉化率為50% | |
| D. | 該條件下反應放出0.5QkJ的熱量 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 .
.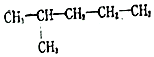 2-甲基戊烷
2-甲基戊烷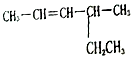 4-甲基-2-己烯.
4-甲基-2-己烯.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 配制100g20%的氫氧化鈉溶液(燒杯、100mL容量瓶、膠頭滴管) | |
| B. | 鈉的焰色反應(鉑絲、硫酸鈉溶液、稀鹽酸) | |
| C. | 從碘水中提取碘(蒸發皿、酒精燈、玻璃棒) | |
| D. | 除去自來水中的Cl-(鐵架臺、玻璃棒、漏斗) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 水解達到平衡時(不飽和),加氯化鐵溶液達飽和,溶液的酸性會增強 | |
| B. | 濃度為5 mol•L-1和0.5 mol•L-1的兩種 FeCl3溶液,其他條件相同時,Fe3+的水解程度前者比后者小 | |
| C. | 有50℃和20℃的同濃度的兩種FeCl3稀溶液,其他條件相同時,Fe3+的水解程度前者比后者小 | |
| D. | 為抑制 Fe3+的水解,較好地保存 FeCl3溶液,應加少量鹽酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 參加反應的物質的性質是決定化學反應速率的主要因素 | |
| B. | 光是影響某些化學反應速率的外界條件之一 | |
| C. | 決定化學反應速率的主要因素是濃度 | |
| D. | 使用正催化劑、升高溫度、增大反應物濃度,都可以增大正反應速率 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com