
| m |
| M |
| 1g |
| 208g/mol |
| 1 |
| 208 |
| 1 |
| 208 |
| 1 |
| 104 |
| m |
| M |
| 1g |
| 342g/mol |
| 1 |
| 342 |
| 1 |
| 342 |
| 1 |
| 57 |
| m |
| M |
| 1g |
| 74.5g/mol |
| 1 |
| 74.5 |
| 1 |
| 74.5 |
| 1 |
| 74.5 |
| m |
| M |
| 1g |
| 160g/mol |
| 1 |
| 160 |
| 1 |
| 160 |
| 1 |
| 80 |


 智趣暑假溫故知新系列答案
智趣暑假溫故知新系列答案 英語小英雄天天默寫系列答案
英語小英雄天天默寫系列答案 暑假作業安徽少年兒童出版社系列答案
暑假作業安徽少年兒童出版社系列答案科目:高中化學 來源: 題型:
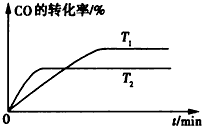
查看答案和解析>>
科目:高中化學 來源: 題型:
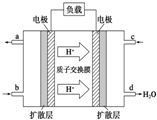
 (1)用50mL 0.55mol/L NaOH溶液和50mL 0.25mol/L H2SO4溶液來做中和熱測定的實驗,測得溶液在反應前后的溫度變化為t1℃~t2℃(t2>t1),混合后溶液的比熱容為c=4.18J/(g?℃),溶液的密度都近似為1g/mL,中和熱△H=
(1)用50mL 0.55mol/L NaOH溶液和50mL 0.25mol/L H2SO4溶液來做中和熱測定的實驗,測得溶液在反應前后的溫度變化為t1℃~t2℃(t2>t1),混合后溶液的比熱容為c=4.18J/(g?℃),溶液的密度都近似為1g/mL,中和熱△H=| 物質 | 炭粉(C) | 一氧化碳(CO) | 氫氣(H2) | 甲烷(CH4) | 乙醇(C2H5OH) |
| 狀態 | 固體 | 氣體 | 氣體 | 氣體 | 液體 |
| 熱量(kJ) | 392.8 | 282.6 | 285.8 | 890.3 | 1 367 |
查看答案和解析>>
科目:高中化學 來源: 題型:
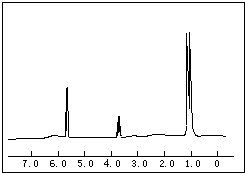 (1)將各有機物的序號填到對應分類中 ①CH3CH2CH3②CH2=CH-CH3③CH3COOCH3④H3C-OH⑤CH3CH2COOH 醇:
(1)將各有機物的序號填到對應分類中 ①CH3CH2CH3②CH2=CH-CH3③CH3COOCH3④H3C-OH⑤CH3CH2COOH 醇: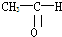 烯烴:
烯烴: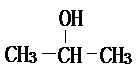 中的一種,根據圖中信息,其結構簡式為:
中的一種,根據圖中信息,其結構簡式為:查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com