
 生物質能是一種潔凈,可再生的能源.生物質氣(主要成分為CO、CO2、H2等)與H2混合,催化合成甲醇是生物質能利用的方法之一.
生物質能是一種潔凈,可再生的能源.生物質氣(主要成分為CO、CO2、H2等)與H2混合,催化合成甲醇是生物質能利用的方法之一.分析 (1)根據鋅的原子序數和構造原理來書寫基態Zn原子的核外電子排布式;
(2)根據等電子原理來書寫CO的結構式;
(3)①利用氫鍵來解釋物質的沸點;利用甲醛中的成鍵來分析碳原子的雜化類型;
②利用雜化類型來分析空間結構,并利用判斷σ鍵的規律來分析σ鍵數目.
解答 解:(1)Zn的原子序數為30,3d電子排滿,3d軌道寫在4s軌道的前面,其電子排布為1s22s22p63s23p63d104s2或[Ar]3d104s2;
故答案為:1s22s22p63s23p63d104s2或[Ar]3d104s2;
(2)依據等電子原理,可知CO與N2為等電子體,N2分子的結構式為N≡N,互為等電子體分子的結構相似,則CO的結構式為C≡O;
故答案為:C≡O;
(3)①甲醇分子之間形成了分子間氫鍵,甲醛分子間只是分子間作用力,而沒有形成氫鍵,故甲醇的沸點高;
甲醛分子中含有碳氧雙鍵,共有3個σ鍵,則碳原子軌道的雜化類型為sp2雜化;
故答案為:甲醇分子之間形成氫鍵;sp2雜化;
②因甲醛中碳原子采取sp2雜化,則分子的空間構型為平面三角形;1mol甲醛分子中含有2mol碳氫σ鍵,1mol碳氧σ鍵,故含有σ鍵的數目為3NA;
故答案為:平面三角形;3NA.
點評 本題主要考查核外電子排布式、等電子體原理、分子間作用力、雜化軌道、共價鍵類型、分子的平面構型,注重了對物質結構中常考考點的綜合,學生易錯點在電子排布中3d與4s的書寫上及雜化類型的判斷上.


 世紀百通期末金卷系列答案
世紀百通期末金卷系列答案科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
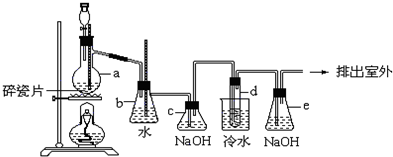
 用50mL 0.50mol/L的鹽酸與50mL 0.55mol/L的氫氧化鈉溶液在如圖所示的裝置中進行中和反應,通過測定反應過程中所放出的熱量可計算中和熱.回答下列問題:?
用50mL 0.50mol/L的鹽酸與50mL 0.55mol/L的氫氧化鈉溶液在如圖所示的裝置中進行中和反應,通過測定反應過程中所放出的熱量可計算中和熱.回答下列問題:?查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 除了③ | B. | ①②④ | C. | ③⑤ | D. | 除了⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2.24 L | B. | 4.48 L | C. | 5.6 L | D. | 11.2 L |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com