
 請回答下列問題.
請回答下列問題.分析 (1)分子晶體熔沸點較低;
(2)①根據N2與CO為等電子體,結合等電子體結構相似判斷;
②據CO2的結構式O=C=O判斷;
(3)可根據硅晶體中Si-Si之間插入O原子形成SiO2分析;
硅原子周圍有四個共價鍵與硅原子相連,其中任意兩個共價鍵向外都可以連有兩個最小的環.
解答 解:(1)分子晶體熔沸點較低,該物質的熔沸點較低,所以為分子晶體,故答案為:分子晶體;
(2)①N2與CO為等電子體,二者結構相似,N2的結構為N≡N,則CO的結構為C≡O,故答案為:C≡O;
②CO2的結構式為O=C=O,分子中C形成2個δ鍵,則1molCO2中含有的σ鍵數目為2×NA=2NA個,故答案為:2NA;
(3)金剛石晶體中,最小的環為六元環,也即由6個C原子構成,則晶體硅的六元環也是六個Si原子.當各Si-Si鍵上插入一個O原子,則共插入六個O原子,故最小的環上共有十二個原子即為十二元環;
晶體硅的結構和金剛石相似,硅原子周圍有四個共價鍵與其相連,其中任意兩個共價鍵向外都可以連有兩個最小的環,如果把Si-O-Si鍵作為一個整體的話,可作如圖所示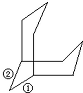 ,所以一個硅原子共用的最小環有C${\;}_{4}^{2}$×2=12種;
,所以一個硅原子共用的最小環有C${\;}_{4}^{2}$×2=12種;
故答案為:12;12.
點評 本題綜合考查物質的結構與性質知識,側重于晶體類型的判斷、等電子體、雜化類型、晶體結構分析等知識,題目難度中等,注意把握雜化類型的判斷方法.


科目:高中化學 來源: 題型:選擇題
| A. | ①③ | B. | ②③ | C. | ②④ | D. | 只有② |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | N-H的鍵長比P-H的鍵長短,所以PH3的沸點比NH3低 | |
| B. | PH3分子的立體構型是三角錐形,與NH3互為等電子體 | |
| C. | PH3分子是極性分子,極易溶于水,因為它與水分子間存在氫鍵 | |
| D. | NH3比PH3穩定,因為NH3分子間存在氫鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1 mol•L-1NaOH溶液:K+、NH4+、I-、NO3- | |
| B. | 0.1 mol•L-1的CH3COOH溶液:CH3CH2OH、Na+、Al3+、SO42- | |
| C. | 0.1 mol•L-1的Na2CO3溶液:K+、Al3+、NO3-、Cl- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1012的溶液:Fe2+、Na+、Cl-、NO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NO3-、NH4+、K+、SO42- | B. | CO32-、Cl-、Na+、K+ | ||
| C. | Mg2+、NO3-、C1-、Fe2+ | D. | K+、Na+、NO3-、SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 物質A~E在水中電離產生下列離子:
物質A~E在水中電離產生下列離子:| 陽離子 | NH4+ H+ Na+ |
| 陰離子 | OH-CH3COO- SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4LH2O(g)含有的分子數約為NA | |
| B. | 常溫常壓下,5.85g NaCl含有的Na+離子數為0.1 NA | |
| C. | 通常狀況下,NA 個CO2分子占有的體積為22.4L | |
| D. | 1L物質的量濃度為0.5mol•/L的CH3COOH溶液中,含有CH3COOH個數為0.5NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com