
| A. | SO42-、CO32-、F- | B. | CO32-、SO42-、F- | C. | CO32-、F-、SO42- | D. | F-、CO32-、SO42- |
分析 析出沉淀時,CaSO4溶液中c(Ca2+)=$\frac{{K}_{sp}(CaS{O}_{4})}{c(S{{O}_{4}}^{2-})}$=$\frac{9.0×1{0}^{-6}}{0.010}$mol/L,CaCO3溶液中c(Ca2+)=$\frac{{K}_{sp}(CaC{O}_{3})}{c(C{{O}_{3}}^{2-})}$=$\frac{5.0×1{0}^{-9}}{0.010}$mol/L,CaF2溶液中c(Ca2+)=$\frac{1.5×1{0}^{-10}}{0.01{0}^{2}}$mol/L,c(Ca2+)越小,則越先生成沉淀,據此進行判斷.
解答 解:析出沉淀時,CaSO4溶液中c(Ca2+)=$\frac{{K}_{sp}(CaS{O}_{4})}{c(S{{O}_{4}}^{2-})}$=$\frac{9.0×1{0}^{-6}}{0.010}$mol/L=9.0×10-4mol/L,CaCO3溶液中c(Ca2+)=$\frac{{K}_{sp}(CaC{O}_{3})}{c(C{{O}_{3}}^{2-})}$=$\frac{5.0×1{0}^{-9}}{0.010}$mol/L=5.0×10-7mol/L,CaF2溶液中c(Ca2+)=$\frac{1.5×1{0}^{-10}}{0.01{0}^{2}}$mol/L=1.5×10-6mol/L,c(Ca2+)越小,則越先生成沉淀,所以三種陰離子產生沉淀的先后順序為CO32-、F-、SO42-,
故選C.
點評 本題考查難溶電解質的溶解平衡的計算與判斷,題目難度中等,注意根據溶解度判斷生成沉淀的先后順序,需要明確組成不相似的物質,不能直接根據溶度積判斷,為易錯點.


科目:高中化學 來源: 題型:選擇題
| A. | 用高錳酸鉀溶液滴定Na2SO3溶液至終點,滴入最后一滴高錳酸鉀溶液,溶液顏色恰好由紫紅色變為無色且半分鐘不變色 | |
| B. | 燃料電池制作的實驗中,石墨棒用海綿包裹是為了更好的固定電極 | |
| C. | pH試紙在檢測溶液時不能濕潤,使用石蕊試紙檢測氣體時需要濕潤并粘在潔凈玻璃棒的一端 | |
| D. | 海帶中提取碘,可將灰化后的海帶加水煮沸一段時間后過濾,在濾液中加入稀硫酸后轉移到分液漏斗中用CCl4萃取分離 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 | Cl-OH |  |  |  |
| 非羥基氧原子數 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中強酸 | 強酸 | 最強酸 |
 .H3PO3和H3AsO3與過量的NaOH溶液反應的化學方程式分別是:
.H3PO3和H3AsO3與過量的NaOH溶液反應的化學方程式分別是:查看答案和解析>>
科目:高中化學 來源: 題型:填空題
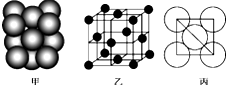 銅單質晶體中原子的堆積方式如圖甲所示,其晶胞如圖乙所示,原子之間相互位置關系的平面圖如圖丙所示.
銅單質晶體中原子的堆積方式如圖甲所示,其晶胞如圖乙所示,原子之間相互位置關系的平面圖如圖丙所示.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 “神七”登天標志著我國的航天事業進入了新的篇章.
“神七”登天標志著我國的航天事業進入了新的篇章.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將銅絲插入濃硫酸加熱,反應后把水加入反應器中,觀察硫酸銅溶液的顏色 | |
| B. | 常溫下將銅絲伸入盛滿氯氣的集氣瓶中,觀察CuCl2的生成 | |
| C. | 金屬鈉放入硫酸銅溶液中可以置換出金屬銅 | |
| D. | 將表面有銅綠[Cu2(OH)2CO3]的銅器放入鹽酸中浸泡,除去銅綠 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 聚氯乙烯分子中含碳碳雙鍵 | B. | 以淀粉為原料可制取乙酸乙酯 | ||
| C. | 戊烷有3種同分異構體 | D. | 油脂的皂化反應屬于水解反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com