
分析 (1)氮原子核外電子數為7,根據能量最低原理書寫最外層電子排布式;
比較非金屬性的強弱,可根據最高價氧化物對應水化物的酸性強弱,與氫氣反應的劇烈程度,氫化物的穩定性,單質之間的置換反應等,對應陰離子的還原性強弱等;
(2)反應中Fe元素的化合價升高,則N元素的化合價降低;維生素C可解毒,說明維生素C能把鐵離子還原為亞鐵離子;
(3)把新制的氯水加到NaNO2溶液中,二者發生氧化還原反應生成NaNO3和HCl;反應中1molNaNO2失去2mol電子;
(4)HNO2的電離常數大于H2CO3,則HNO2的酸性強,HNO2溶液與Na2CO3溶液等體積混合生成NaNO2和NaHCO3,二者均能水解顯堿性,HCO3-的水解程度大;
解答 解:(1)氮原子核外電子數為7,基態原子核外電子排布為1S12S22P3,故最外層電子排布式為2s22p3;
a.氫化物的穩定性越強,其非金屬性越強,已知氫化物穩定性:H2O>NH3 ,則非金屬性O大于N,故a正確;
b.氫化物的沸點屬于物理性質,與元素的非金屬性無關,所以不能根據沸點:H2O>NH3,來比較O與N的非金屬性,故b錯誤;
c.化合物中非金屬性強的元素吸引電子能力強先負價,已知NO中N為+2價,O為-2價,所以非金屬性O大于N,故c正確;
d.不能根據氫化物的堿性判斷元素的非金屬性,故d錯誤;
故答案為:2s22p3;ac;
(2)反應中Fe元素的化合價升高,則N元素的化合價降低,所以NaNO2作氧化劑,發生還原反應;維生素C可解毒,說明維生素C能把鐵離子還原為亞鐵離子,維生素C作還原劑,具有還原性;
故答案為:還原;還原;
(3)氯水加到NaNO2溶液中,二者發生氧化還原反應生成NaNO3和HCl,反應的化學方程式為:NaNO2+Cl2+H2O=NaNO3+2HCl,反應中1molNaNO2失去2mol電子生成1mol;若生成0.1mol NaNO3,則轉移0.2mol電子,即0.2NA;
故答案為:NaNO2+Cl2+H2O=NaNO3+2HCl;0.2NA;
(4)HNO2的電離常數大于H2CO3,則HNO2的酸性強,HNO2溶液與Na2CO3溶液等體積混合生成NaNO2和NaHCO3,二者均能水解顯堿性,但是HCO3-的水解程度大,HCO3-還能發生很少量的電離,則溶液中陰離子濃度關系為c(NO2-)>c(HCO3-)>c(OH-)>c(CO32-);
故答案為:c(NO2-)>c(HCO3-)>c(OH-)>c(CO32-).
點評 本題考查了電子排布式、元素非金屬性強弱的判斷、氧化還原反應、離子濃度大小比較等,題目難度中等,題目涉及的知識點較多,側重于考查學生對基礎知識的綜合應用能力,注意把握電離常數與酸性強弱的關系.


 字詞句篇與同步作文達標系列答案
字詞句篇與同步作文達標系列答案 走進文言文系列答案
走進文言文系列答案科目:高中化學 來源: 題型:解答題
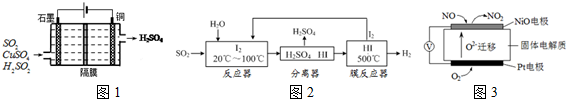
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 ,乙為
,乙為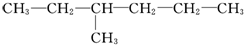 .下列有關它們命名的說法正確的是( )
.下列有關它們命名的說法正確的是( )| A. | 甲、乙的主鏈碳原子數都是6個 | B. | 甲、乙的主鏈碳原子數都是5個 | ||
| C. | 甲的名稱為2-丙基-1-丁烯 | D. | 乙的名稱為3-甲基己烷 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鐵和鹽酸反應 2Fe+6H+═2Fe3++3H2↑ | |
| B. | 小蘇打溶液與少量澄清石灰水混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | Na2CO3溶液中通入少量CO2:CO32-+CO2+H2O═2HCO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 質子數為8、中子數為10的氧原子:${\;}_{8}^{10}$O | |
| B. | 氧離子(O2-)的結構示意圖: | |
| C. | 某氧單質的球棍模型: | |
| D. | 某碳氧化合物電子式: |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 化學和環境保護、食品營養、材料應用等密切相關.
化學和環境保護、食品營養、材料應用等密切相關. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用小蘇打治療胃酸過多:CO3-+2H+═CO2↑+H2O | |
| B. | 鈉與水反應:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 硫酸銅溶液中加入過量鐵粉:Cu2++2Fe═2Fe3++Cu | |
| D. | 用氫氧化鈉溶液除去鋁表面的氧化膜:Al2O3+2OH-═2AlO${\;}_{2}^{-}$+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com