
| A. | 工業上從海水中提取金屬鎂所發生的化學反應中,不涉及的物質是HCl | |
| B. | 工業上用氯氣與澄清石灰水反應制取漂白粉 | |
| C. | 工業煉鐵中用石灰石除去鐵礦石中的脈石 | |
| D. | 工業上通常用氫氧化鈉和煤一起混合燃燒,為了避免二氧化硫污染空氣 |
分析 A.從海水中提取鎂的步驟為:①把貝殼制成石灰乳;②在引入的海水中加入石灰乳,沉降、洗滌、過濾沉淀物;③將沉淀物與鹽酸反應,結晶、過濾、干燥產物;④將產物電解得到金屬鎂;
B.澄清石灰水氫氧化鈣濃度低,應該用Cl2與石灰乳制取漂白粉;
C.高爐煉鐵時,使用石灰石的目的是:將礦石中的二氧化硅轉變為爐渣,即除去脈石(SiO2);
D.為了防止煤燃燒生成二氧化硫污染空氣,通常在煤燃燒時加入一些生石灰(CaO),使燃燒時產生的二氧化硫和生石灰(CaO)發生化合反應生成一種固體產物,從而達到固硫的目的.
解答 解:A.把貝殼制成石灰乳,涉及反應:CaCO3$\frac{\underline{\;高溫\;}}{\;}$CaO+CO2↑、CaO+H2O═Ca(OH)2;在引入的海水中加入石灰乳,沉降、過濾、洗滌沉淀物,涉及反應:MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2;將沉淀物與鹽酸反應,結晶、過濾、干燥產物,涉及反應:Mg(OH)2+2HCl=MgCl2+2H2O,MgCl2•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgCl2+6H2O;④將產物電解得到金屬鎂,涉及反應:MgCl2$\frac{\underline{\;電解\;}}{\;}$Mg+Cl2↑,從海水中提取金屬鎂所發生的化學反應中,涉及HCl,故A錯誤;
B.因為澄清石灰水中Ca(OH)2的濃度太小,故應該用Cl2與石灰乳制取漂白粉,故B錯誤;
C.煉鐵時,石灰石中的碳酸鈣在高溫條件下分解能生成氧化鈣和二氧化碳,氧化鈣能和二氧化硅反應生成硅酸鈣,從而除去鐵礦石中的二氧化硅,故C正確;
D.高溫條件下,二氧化硫和生石灰化合生成了亞硫酸鈣,反應的化學方程式是:CaO+SO2$\frac{\underline{\;高溫\;}}{\;}$CaSO3,從而達到固硫的目的,故D錯誤;
故選C.
點評 本題考查了有關化學工藝的一些知識,掌握從海水中提取金屬鎂原理、制取漂白粉的原理、工業煉鐵除去鐵礦石中的脈石方法、燃煤除硫的原理是解答的關鍵,題目難度中等.


 考前必練系列答案
考前必練系列答案科目:高中化學 來源: 題型:解答題
 A、B、C、D、E各物質的轉化關系如圖所示.
A、B、C、D、E各物質的轉化關系如圖所示.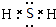 ;
;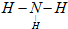 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | KCl是還原產物,KClO3是氧化產物 | |
| B. | KOH在該反應中體現堿性和還原性 | |
| C. | 反應中每消耗3 mol Cl2,轉移電子數為5NA | |
| D. | 被還原的氯氣的物質的量是被氧化的氯氣的物質的量的5倍 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鈉投入到CuSO4溶液中:2Na+Cu2+═Cu↓+2Na+ | |
| B. | 澄清石灰水中加過量小蘇打:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 氫氧化鋁中滴入足量鹽酸:Al(OH)3+3H+═Al3++3H2O | |
| D. | 四氧化三鐵粉末投入到足量鹽酸中:Fe3O4+8H+═3Fe3++4H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
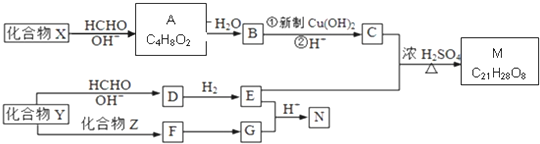
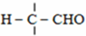 $\stackrel{OH-}{→}$
$\stackrel{OH-}{→}$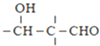
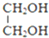 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$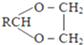 +H2O
+H2O =
= =
=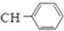
 ;由G、E生成N的反應類型是取代反應.
;由G、E生成N的反應類型是取代反應. D的結構簡式:
D的結構簡式:

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CO2氣體通入Na2SiO3溶液中 | B. | SO2氣體通入Ca(OH)2溶液中 | ||
| C. | CO2氣體通入飽和Na2CO3溶液中 | D. | SO2氣體通入CaCl2溶液中 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 陶瓷的主要成分是硅酸鹽 | B. | 硅可用作半導體材料 | ||
| C. | 電解氯化鈉溶液制取金屬鈉和氯氣 | D. | 鐵槽可存放冷的濃硝酸、濃硫酸 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com