
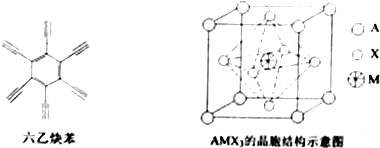
分析 (1)Cu屬于29號元素,根據構造原理書寫基態核外價電子排布式;
(2)根據價層電子對互斥理論確定原子雜化方式;每摩爾單鍵、雙鍵或三鍵中只有一摩爾δ鍵;
(3)①根據等電子體中原子數相同、價電子數相同分析,CH3NH3+的電子數為18,原子數為8;
②根據晶胞結構判斷,與A離子距離最近的M離子處于晶胞的體心上,A離子位于晶胞頂點,M離子位于體心;
③PbI2難溶于水,可溶于HI溶液,生成H2[PbI4],根據強酸制弱酸原理書寫.
解答 解:(1)Cu屬于29號元素,根據構造原理知Cu基態核外電子排布式1s22s22p63s23p63d104s1 ,故價電子排布式為3d104s1,
故答案為:3d104s1;
(2)碳碳三鍵中C原子價層電子對個數是2且不含孤電子對,所以雜化方式為sp;苯環中的碳形成3個δ鍵,無孤電子對,采取sp2雜化,1mol六乙炔苯中共含有包括碳碳鍵和碳氫鍵在內的化合鍵24mol,而每摩爾單鍵、雙鍵或三鍵中只有一摩爾δ鍵,所以1mol六乙炔苯中含有δ鍵的數目為24mol或24×6.02×1023個,
故答案為:sp、sp2;24mol或24×6.02×1023個;
(3)①CH3NH3+的電子數為18,原子數為8,其等電子體的一種分子為CH3CH3或C2H6 ,
故答案為:CH3CH3或C2H6;
②根據晶胞結構可知,與A離子距離最近的M離子處于晶胞的體心上,A離子位于晶胞頂點,M離子位于體心,所以每個A離子周圍最近且等距離的M離子數目為8,
故答案為:8;
③PbI2難溶于水,可溶于HI溶液,生成H2[PbI4],反應的離子方程式為PbI2+2I-=[PbI4]2-,
故答案為:PbI2+2I-=[PbI4]2-.
點評 本題考查了價電子的排布式、晶胞的計算、原子雜化方式判斷等知識點,題目難度中等,注意識記中學常見的晶胞結構.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該溶液的溶質不可能是NaHSO4 | |
| B. | 向該溶液中加入鋁粉,一定能產生大量H2 | |
| C. | 下列離子在該溶液中一定能大量共存:Cl-、K+、Cu2+ | |
| D. | 向該溶液中加入NaHCO3固體,一定有化學反應發生 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溫度(℃) | 25 | t1 | t2 |
| 水的離子積常數 | 1×10-14 | α | 1×10-13 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | a=b | B. | a<b | C. | a>b | D. | 不能確定 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
. .②E→Fn
.②E→Fn +nHOCH2CH2OH$→_{△}^{濃硫酸}$
+nHOCH2CH2OH$→_{△}^{濃硫酸}$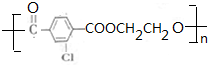 +2nH2O.
+2nH2O. 和另一種含氮有機分子G,G分子既能與氫氧化鈉溶液反應,也能與鹽酸反應.G分子中氮元素的質量分數為8.8%.
和另一種含氮有機分子G,G分子既能與氫氧化鈉溶液反應,也能與鹽酸反應.G分子中氮元素的質量分數為8.8%.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
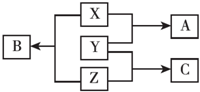 X、Y、Z三種短周期元素,其單質在常溫下均為無色氣體,它們的原子序數之和為16,在適當條件下三種單質兩兩直接化合,可發生如圖所示變化.已知一個B分子中含有Z元素的原子個數比C分子中的Z元素的原子個數少一個.請回答下列問題:
X、Y、Z三種短周期元素,其單質在常溫下均為無色氣體,它們的原子序數之和為16,在適當條件下三種單質兩兩直接化合,可發生如圖所示變化.已知一個B分子中含有Z元素的原子個數比C分子中的Z元素的原子個數少一個.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;
; 2NH3;
2NH3;查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com