
 ;
; 2NH3;
2NH3;分析 A、B、C、D、E是短周期中的5種非金屬元素,它們的原子序數依次增大.A元素原子形成的離子就是一個質子,則A為H元素;B原子的最外層電子數是內層電子數的2倍,原子只能有2個電子層,最外層電子數為4,故B為碳元素;E的單質為黃色晶體,易溶于二硫化碳,則E為S元素;E元素與D元素同主族,則D為O元素;C、D在元素周期表中處于相鄰的位置,且D的原子序數大,則C為N元素,據此解答.
解答 解:A、B、C、D、E是短周期中的5種非金屬元素,它們的原子序數依次增大.A元素原子形成的離子就是一個質子,則A為H元素;B原子的最外層電子數是內層電子數的2倍,原子只能有2個電子層,最外層電子數為4,故B為碳元素;E的單質為黃色晶體,易溶于二硫化碳,則E為S元素;E元素與D元素同主族,則D為O元素;C、D在元素周期表中處于相鄰的位置,且D的原子序數大,則C為N元素.
(1)由上述分析可知,B為C元素、C為N元素,故答案為:C;N;
(2)E的陰離子為S2-,離子結構示意圖: ,故答案為:
,故答案為: ;
;
(3)A的單質為氫氣、C的單質為氮氣,二者在一定條件下反應生成化合物X為NH3,反應方程式為:N2+3H2 2NH3,
2NH3,
故答案為:N2+3H2 2NH3;
2NH3;
(4)9g碳單質的物質的量是$\frac{9g}{12g/mol}$=0.75mol,完全燃燒生成CO2為0.75mol,NaOH的物質的量為1L×1mol/L=1mol,二氧化碳與氫氧化鈉的物質的量之比為3:4,由CO2+NaOH=NaHCO3、CO2+2NaOH=Na2CO3+H2O可知,產物是Na2CO3、NaHCO3的混合物,令碳酸鈉與碳酸氫鈉的物質的量分別為xmol、ymol,根據碳元素守恒由x+y=0.75,根據鈉元素守恒有2x+y=1,聯立方程,解得x=0.25,y=0.5,離子水解程度微弱,故溶液中(除Na+外)濃度最大的離子是 HCO3-,
故答案為:HCO3-.
點評 本題考查結構性質與位置關系應用,難度中等,(4)中判斷二氧化碳與氫氧化鈉的反應產物是關鍵.


 發散思維新課堂系列答案
發散思維新課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 鎂粉中混有少量鋁粉:加入過量燒堿溶液充分反應,過濾 | |
| B. | KNO3固體中混有少量NaCl:加H2O配制熱的飽和溶液,再冷卻結晶、過濾 | |
| C. | 乙醇中的少量水:加入適量新制的生石灰,加熱蒸餾 | |
| D. | 二氧化碳中混有少量一氧化碳:點燃除去 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 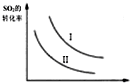 如圖研究的是溫度、壓強對平衡的影響,橫坐標表示壓強 | |
| B. | 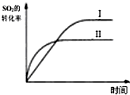 如圖研究的是溫度對平衡的影響,Ⅱ采用的溫度更高 | |
| C. |  圖中t0時使用了催化劑,使平衡向正反應方向進行 | |
| D. | 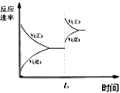 圖中t0時增大壓強,使平衡向負反應方向進行 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
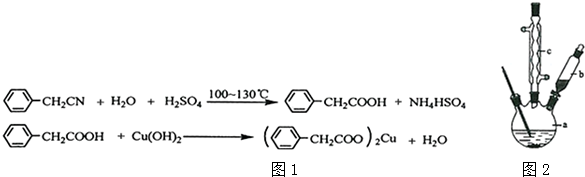
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 玉是石灰石 | B. | 玉的硬度比河砂大 | ||
| C. | 玉的熔點較高 | D. | 玉是金剛砂 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
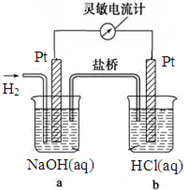 如圖向a中通入H2,發現靈敏電流計指針發生偏轉,持續通入H2可觀察到b中鉑電極表面有少量氣泡產生,負極反應式為H2-2e-+2OH-=2H2O,電池的總反應為HCl+NaOH=H2O+NaCl.
如圖向a中通入H2,發現靈敏電流計指針發生偏轉,持續通入H2可觀察到b中鉑電極表面有少量氣泡產生,負極反應式為H2-2e-+2OH-=2H2O,電池的總反應為HCl+NaOH=H2O+NaCl.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com