

分析 I.①Mg在二氧化碳中燃燒生成C和MgO;
②根據元素的化合價變化及電子轉移的數目來用“雙線橋法”表示反應中電子轉移的方向和總數,箭頭的起點和終點都指向同種元素;
II.少量CO2通入過量的KOH溶液中生成碳酸鉀和水;CO2與Ca(OH)2反應生成碳酸鈣沉淀,當CO2過量碳酸鈣又溶解生成碳酸氫鈣;
III.CO2通入KOH和Ca(OH)2的混合溶液中,CO2先與Ca(OH)2反應生成碳酸鈣沉淀,然后再與KOH反應生成碳酸鉀,二氧化碳過量時與碳酸鉀反應生成碳酸氫鉀、與碳酸鈣反應生成碳酸氫鈣.
解答 解:Ⅰ.①Mg在二氧化碳中燃燒生成C和MgO,其反應為2Mg+CO2$\frac{\underline{\;點燃\;}}{\;}$2MgO+C,Mg元素的化合價升高被氧化,則氧化產物為MgO,故答案為:MgO;
②在反應2Mg+CO2$\frac{\underline{\;點燃\;}}{\;}$2MgO+C中,C元素的化合價由+4降低為0,得4e-,Mg元素的化合價由0升高到+2,失2×2e-,則
用“雙線橋法”表示反應中電子轉移的方向和總數為 ,
,
故答案為: ;
;
Ⅱ.①少量CO2通入過量的KOH溶液中生成碳酸鉀和水,反應的離子方程式為CO2+2OH-=CO32-+H2O,故答案為:CO2+2OH-=CO32-+H2O;
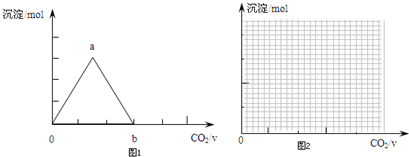
②CO2與Ca(OH)2反應生成碳酸鈣沉淀,當CO2過量碳酸鈣又溶解生成碳酸氫鈣,則圖中沉淀變化由a到b的離子方程式:CaCO3+CO2+H2O=Ca2++2HCO3-;
故答案為:CaCO3+CO2+H2O=Ca2++2HCO3-;
Ⅲ.CO2通入KOH和Ca(OH)2的混合溶液中,CO2先與Ca(OH)2反應生成碳酸鈣沉淀,發生Ca2++CO2+2OH-=CaCO3↓+H2O,生成的碳酸鈣沉淀的物質的量與II中相同,然后再與KOH反應生成碳酸鉀,反應的離子方程式為:CO2+2OH-=CO32-+H2O,二氧化碳過量時與碳酸鉀反應生成碳酸氫鉀,此時碳酸鈣沉淀的物質的量不變,反應的離子方程式為:CO32-+CO2+H2O=2HCO3-,最后與碳酸鈣反應生成碳酸氫鈣,發生CaCO3+CO2+H2O=Ca2++2HCO3-,沉淀的物質的量減少,最后消失,則生成沉淀的物質的量(n)和通入CO2體積(V)的關系圖為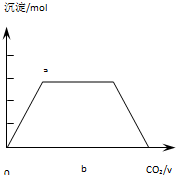 ,
,
故答案為: ;Ca2++CO2+2OH-=CaCO3↓+H2O、CO2+2OH-=CO32-+H2O、CO32-+CO2+H2O=2HCO3-、CaCO3+CO2+H2O=Ca2++2HCO3-.
;Ca2++CO2+2OH-=CaCO3↓+H2O、CO2+2OH-=CO32-+H2O、CO32-+CO2+H2O=2HCO3-、CaCO3+CO2+H2O=Ca2++2HCO3-.
點評 本題考查了氧化還原反應、雙線橋法的應用、離子反應、二氧化碳的性質等,題目難度中等,側重于考查學生分析能力和對基礎知識的綜合應用能力.


 中考解讀考點精練系列答案
中考解讀考點精練系列答案 各地期末復習特訓卷系列答案
各地期末復習特訓卷系列答案 小博士期末闖關100分系列答案
小博士期末闖關100分系列答案科目:高中化學 來源: 題型:選擇題
| A. | 澄清石灰水與稀鹽酸反應:Ca(OH)2+2H+═Ca2++2H20 | |
| B. | 碳酸鈉溶液與少量鹽酸反應:CO32-+2H+═H2O+CO2↑ | |
| C. | 稀硫酸與氫氧化鋇溶液反應:H++OH-+Ba2++SO42-═H2O+BaSO4↓ | |
| D. | 氫氧化銅與稀硫酸反應:Cu(OH)2+2H+═Cu2++2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 可以用澄清的石灰水鑒別SO2和CO2 | |
| B. | SO2能使溴水、KMnO4溶液迅速褪色 | |
| C. | 硫粉在過量的氧氣中燃燒可得到SO3 | |
| D. | 少量SO2通入到濃的CaCl2溶液能生成白色沉淀 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 X、Y、Z、W、R是原子序數依次增大的前四周期元素.X的單質在Y2中燃燒可生成XY和XY2兩種氣體;Z的單質在Y2中燃燒的產物ZY2可使品紅溶液褪色;W的單質是黃綠色的有毒氣體;R3+離子的3d軌道半充滿.請回答下列問題:
X、Y、Z、W、R是原子序數依次增大的前四周期元素.X的單質在Y2中燃燒可生成XY和XY2兩種氣體;Z的單質在Y2中燃燒的產物ZY2可使品紅溶液褪色;W的單質是黃綠色的有毒氣體;R3+離子的3d軌道半充滿.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 合成氨工業對國民經濟和社會發展具有重要的意義.對于密閉容器中的反N2(g)+3H2(g)?2NH3(g),673K、30MPa下n(NH3)和n(H2)隨時間變化的關系如圖所示.下列敘述正確的是( )
合成氨工業對國民經濟和社會發展具有重要的意義.對于密閉容器中的反N2(g)+3H2(g)?2NH3(g),673K、30MPa下n(NH3)和n(H2)隨時間變化的關系如圖所示.下列敘述正確的是( )| A. | 點a時正反應速率比逆反應速率小 | |
| B. | 點d:v正(H2)=3v逆(N2) | |
| C. | 點d(t1時刻)和點e(t2時刻)處n(N2)不一樣 | |
| D. | 點c處反應達到平衡 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 銅、碳、氮、硫、氯等是組成物質的重要元素.
銅、碳、氮、硫、氯等是組成物質的重要元素.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙醇、乙二醇、丙三醇互為同系物,同系物之間不可能為同分異物體 | |
| B. | 北京奧運會獎牌--“金鑲玉”獎牌玉的化學成分多為含水鈣鎂硅酸鹽,如:Ca2Mg5Si8O22(OH)2可用氧化物表示為:2CaO•5MgO•8SiO2•H2O | |
| C. | 次氯酸的結構式為:H-Cl-O | |
| D. | 丙烷分子的比例模型示意圖: |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 污染指數 | 首要污染物 | 空氣質量級別 | 空氣質量狀況 |
| 55 | SO2 | II | 良 |

查看答案和解析>>
科目:高中化學 來源: 題型:多選題
 5、常溫下,反應CO2(g)+3H2(g)?CH3OH(l)+H2O(l)的能量變化如圖所示.反應達到平衡后,要使該反應化學平衡向右移動,其他條件不變,可采取的措施是( )
5、常溫下,反應CO2(g)+3H2(g)?CH3OH(l)+H2O(l)的能量變化如圖所示.反應達到平衡后,要使該反應化學平衡向右移動,其他條件不變,可采取的措施是( )| A. | 升高溫度 | B. | 分離出甲醇 | ||
| C. | 縮小反應器體積 | D. | 使用合適的催化劑 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com