
| 污染指數(shù) | 首要污染物 | 空氣質(zhì)量級別 | 空氣質(zhì)量狀況 |
| 55 | SO2 | II | 良 |

分析 (1)①根據(jù)濃硫酸具有吸水性分析;②二氧化硫氣體不能使干燥的藍色試紙變色;C裝置內(nèi)生成了亞硫酸;③二氧化硫是有毒的氣體,可被氫氧化鈉吸收生成亞硫酸鈉和水,據(jù)此書寫方程式;
(2)根據(jù)溶液的酸堿性與pH的關(guān)系進行解答,當溶液的pH<7顯酸性,當溶液的pH=7顯中性,當溶液的pH>7顯堿性;亞硫酸易被空氣中的氧氣氧化,最終生成H2S04;
(3)SO2與空氣中的O2在飄塵的作用下反應生成SO3,SO3溶于降水生成H2SO4,飄塵起催化作用;
(4)二氧化氮溶于水,生成硝酸和一氧化氮,按一定比例混合一氧化氮氧氣和水,或二氧化氮和氧氣和水可幾乎完全轉(zhuǎn)化為硝酸,據(jù)此答題.
解答 解:(1)①二氧化硫與濃硫酸不反應,濃硫酸有吸水性,可以吸收二氧化硫中的水蒸氣,所以濃硫酸的作用為:干燥二氧化硫氣體,
故答案為:干燥;
②裝置B內(nèi)藍色石蕊試紙雖然與二氧化硫氣體接觸,但卻不變色,可以說明二氧化硫氣體不能使干燥的藍色試紙變色;C裝置內(nèi)二氧化硫與水形成亞硫酸,酸能使?jié)駶櫟乃{色石蕊試紙變紅,反應方程式為S02+H20?H2S03,
故答案為:紅;
③二氧化硫任意排放會造成酸雨,為了防止污染空氣,用氫氧化鈉溶液吸收;反應的化學方程式是S02+2NaOH=Na2S03+H20,
故答案為:吸收多余SO2氣體,避免污染空氣;S02+2NaOH=Na2S03+H20;
(2)當溶液的pH<7顯酸性,當溶液的pH=7顯中性,當溶液的pH>7顯堿性,S02與水反應生成了亞硫酸,溶液顯酸性,所以溶液的pH<7,亞硫酸易被空氣中的氧氣氧化成硫酸,硫酸是強酸,酸性增強,所以PH變小,反應的離子方程式為2H2SO3+O2=4H++2SO42-,
故答案為:<;變小;2H2SO3+O2=4H++2SO42-;
(3)S02與空氣中的02在飄塵的作用下反應生成S03,而飄塵的質(zhì)量和性質(zhì)在反應前后不發(fā)生變化,說明此過程中飄塵作催化劑,
故答案為:催化劑;
(4)氮的氧化物在空氣中:2NO+O2=2NO2,3NO2+H2O=2HNO3+NO,4NO2+O2+2H2O═4HNO3,4NO+3O2+2H2O═4HNO3,所以氮的氧化物溶于水最終轉(zhuǎn)化為硝酸,
故答案為:HNO3.
點評 本題主要考查了酸雨的形成,側(cè)重考查了二氧化硫的性質(zhì),注意二氧化硫?qū)諝獾奈廴竞投趸虻奈盏姆磻恚}目難度中等.


 黃岡天天練口算題卡系列答案
黃岡天天練口算題卡系列答案科目:高中化學 來源: 題型:解答題
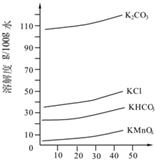 實驗室用MnO2、KOH及KClO3為原料制取高錳酸鉀的實驗流程如下:
實驗室用MnO2、KOH及KClO3為原料制取高錳酸鉀的實驗流程如下: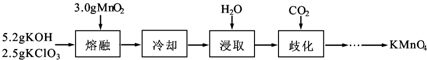
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
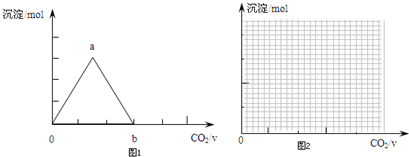
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成兩份.向其中一份中逐漸加入銅粉,最多能溶解9.6g.向另一份中逐漸加入鐵粉,產(chǎn)生氣體的量隨鐵粉質(zhì)量增加的變化如圖所示 (已知硝酸只被還原為NO氣體).
某稀硫酸和稀硝酸的混合溶液200mL,平均分成兩份.向其中一份中逐漸加入銅粉,最多能溶解9.6g.向另一份中逐漸加入鐵粉,產(chǎn)生氣體的量隨鐵粉質(zhì)量增加的變化如圖所示 (已知硝酸只被還原為NO氣體).查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗操作 | 預期現(xiàn)象及實驗結(jié)論 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HCO3-,Cl-,Na+,Ba2+ | B. | AlO2-,S2-,Na+,K+ | ||
| C. | SiO32-,Cl-,K+,Na+ | D. | Ba2+,Al3+,NO3-,Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 應用托盤天平稱取20g NaOH固體 | |
| B. | 配制過程中所用玻璃棒的作用是攪拌和引流 | |
| C. | NaOH固體在燒杯中稱量時間過長,所配NaOH溶液的濃度偏大 | |
| D. | 定容搖勻后,發(fā)現(xiàn)液面下降,繼續(xù)加水至刻度線,對所配NaOH溶液的濃度無影響 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
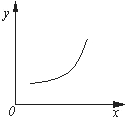 汽車尾氣凈化中的反應為2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.8kJ•mol-1.該反應在恒容的密閉容器中達到平衡后,若僅改變下圖中橫坐標x的值,重新達到平衡后,縱坐標y隨x變化趨勢合理的是( )
汽車尾氣凈化中的反應為2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.8kJ•mol-1.該反應在恒容的密閉容器中達到平衡后,若僅改變下圖中橫坐標x的值,重新達到平衡后,縱坐標y隨x變化趨勢合理的是( )| 選項 | x | y |
| A | 壓強 | 氣體的平均相對分子質(zhì)量 |
| B | 溫度 | 平衡常數(shù)K |
| C | NO的濃度 | NO的轉(zhuǎn)化率 |
| D | 溫度 | 容器內(nèi)混合氣體的密度 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com