
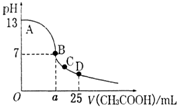
 室溫下,在25mL 0.1mol.L-1NaOH溶液中逐滴加入0.2mol•L-1 CH3COOH 溶液,pH 與滴加 CH3COOH溶液體積的關系曲線如圖所示,若忽略兩溶液混合時的體積變化,下列有關粒子濃度關系的說法錯誤的是( )
室溫下,在25mL 0.1mol.L-1NaOH溶液中逐滴加入0.2mol•L-1 CH3COOH 溶液,pH 與滴加 CH3COOH溶液體積的關系曲線如圖所示,若忽略兩溶液混合時的體積變化,下列有關粒子濃度關系的說法錯誤的是( )| A. | 全部正確 | B. | ①② | C. | ①③ | D. | ②④ |
分析 ①根據溶液中的電荷守恒判斷;
②a=12.5時,氫氧化鈉和醋酸溶液按照物質的量之比1:1反應生成的CH3COONa為強堿弱酸鹽,溶液顯堿性,pH>7;
③C點時,醋酸過量,溶液的組成為醋酸和醋酸鈉的混合物,溶液顯酸性,澤爾c(H+)>c(OH-),結合電荷守恒判斷;
④在D點時,反應后溶質為等濃度的醋酸和醋酸鈉,溶液呈酸性,則醋酸的電離程度等于醋酸根離子的水解程度,則c(CH3COO-)>(CH3COOH).
解答 解:①在A、B間任一點的溶液中都滿足電荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故①正確;
②a=12.5時,醋酸和氫氧化鈉的物質的量之比為1:1,反應后溶液的組成為醋酸鈉,CH3COONa為強堿弱酸鹽,溶液顯堿性,溶液的pH>7,應該介于AB之間,故②錯誤;
③C點時,醋酸過量,溶液的組成為醋酸和醋酸鈉的混合物,溶液呈酸性,則c(H+)>c(OH-),根據電荷守恒可得:c(CH3COO-)>c(Na+),溶液中離子濃度大小為:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故③正確;
④在D點時,反應后溶質為等濃度的醋酸和醋酸鈉,由于醋酸的電離程度等于醋酸根離子的水解程度,則c(CH3COO-)>(CH3COOH),故④錯誤;
故選D.
點評 本題考查了酸堿混合的定性判斷、離子濃度大小比較,題目難度中等,明確溶液酸堿性與溶液pH的關系為解答關鍵,注意掌握電荷守恒、物料守恒及鹽的水解原理在判斷離子濃度大小中的應用方法.


 考前必練系列答案
考前必練系列答案科目:高中化學 來源: 題型:選擇題
| A. | 1mol CH3+(碳正離子)中含有質子數為8NA | |
| B. | 6.4gCu與足量的硫反應,轉移電子數為0.2 NA | |
| C. | 標準狀況下,將分子總數為NA的NH3和HCl的充分混合后,所得混合氣體體積越為22.4L | |
| D. | 7.8g Na2O2中含有的離子總數目為0.3NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na和O2 | B. | Ca(OH)2和CO2 | C. | NaOH和HCl | D. | Na2CO3和HCl |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
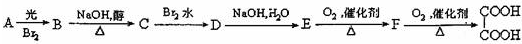
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 溫度/℃ | n(活性炭)/mol | n(CO2)/mol |
| T1 | 0.70 | |
| T2 | 0.25 |
| A. | 上述信息可推知:T1<T2 | |
| B. | T1℃時,該反應的平衡常數K=$\frac{9}{16}$ | |
| C. | T1℃時,若開始時反應物的用量均減小一半,平衡后NO的轉化率減小 | |
| D. | T2℃時,若反應達平衡后再縮小容器的體積,c(N2):c(NO)不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
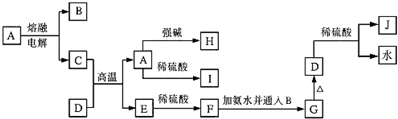
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com