
【題目】FeCl3是重要的化工原料,無水氯化鐵在300℃以上升華,遇潮濕空氣極易潮解
(1)制備無水氯化鐵

①儀器X的名稱為____。
②裝置的連接順序為a→____→i,k→____(按氣流方向,用小寫字母表示)。
③實驗結束后,取少量F中的固體加水溶解,經檢測發現溶液中含有Fe2+,其原因為____。
(2)探究FeCl3與SO2的反應
已知反應體系中存在下列兩種化學變化:
(i) Fe3+與SO2發生絡合反應生成Fe(SO2)62+(紅棕色);
(ii) Fe3+與SO2發生氧化還原反應,其離子方程式為①____

②_________
③_________
④實驗結論:反應(i)、(ii)的活化能大小關系是:E(i)____E(ii)(填“>”、 “<”或“=”,下同),平衡常數大小關系是:K(i)__________K(ii)。
⑤另取5 mL l mol![]() L-l FeC13溶液,先滴加2滴濃鹽酸,再通入SO2至飽和。幾分鐘后,溶液由黃色變為淺綠色,由此可知:促使氧化還原反應(ii)快速發生可采取的措施是____。
L-l FeC13溶液,先滴加2滴濃鹽酸,再通入SO2至飽和。幾分鐘后,溶液由黃色變為淺綠色,由此可知:促使氧化還原反應(ii)快速發生可采取的措施是____。
【答案】圓底燒瓶 h,i→d,e g,f→b(c) 未升華出來的FeCl3與未反應的鐵粉在水溶液中反應生成Fe2+ SO2+2Fe3++2H2O=4H++SO42-+2Fe2+ Fe(OH)3膠體 生成藍色沉淀 < < 增強FeCl3溶液的酸性
【解析】
(1)首先制取氯氣,然后除雜、干燥,再與鐵粉反應,冷凝法收集升華出的FeCl3,最后連接盛有堿石灰的干燥管,吸收未反應的氯氣,防止空氣中的水蒸氣使FeCl3水解。F中剩余固體可能為未升華的FeCl3與未反應的鐵粉的混合物,溶于水發生反應可生成FeCl2,以此分析解答;
(2) ①Fe3+與SO2發生氧化還原反應生成Fe2+和SO42-,根據得失電子守恒、電荷守恒和原子守恒寫出離子方程式;
②沒有出現丁達爾現象,說明紅棕色物質不是Fe(OH)3膠體;
③用K3Fe(CN)6溶液檢驗Fe2+生成藍色沉淀;
④反應(i)比反應(ii)快,則活化能:E(i)<E(ii);反應(ii)進行的程度更大,則平衡常數:K(i)<K(ii);
⑤增強FeCl3溶液的酸性能使氧化還原反應(ii)加快。
(1)①由儀器構造可知,儀器X的名稱為圓底燒瓶,
故答案為:圓底燒瓶;
②首先制取氯氣,然后除雜、干燥,導管應長進短出,所以a連接h,i接d;在F中與鐵粉反應,為防止FeCl3堵塞導管,出氣導管應用粗導管,則e接j,冷凝法收集升華出的FeCl3,所以k接g;最后連接盛有堿石灰的干燥管,吸收未反應的氯氣,所以f接b,則裝置的連接順序為a→h,i→d,e→i,k→g,f→b,
故答案為:h,i→d,e;g,f→b(c);
③實驗結束后,取少量F中的固體加水溶解,經檢測發現溶液中含有Fe2+,其原因為未升華出來的FeCl3與未反應的鐵粉在水溶液中反應生成Fe2+,
故答案為:未升華出來的FeCl3與未反應的鐵粉在水溶液中反應生成Fe2+;
(2) ①Fe3+與SO2發生氧化還原反應生成Fe2+和SO42-,根據得失電子守恒、電荷守恒和原子守恒,離子方程式為SO2+2Fe3++2H2O=4H++SO42-+2Fe2+,
故答案為:SO2+2Fe3++2H2O=4H++SO42-+2Fe2+;
②沒有出現丁達爾現象,說明紅棕色物質不是Fe(OH)3膠體,
故答案為:Fe(OH)3膠體;
③K3Fe(CN)6和Fe2+生成藍色沉淀,
故答案為:生成藍色沉淀;
④由實驗現象可知,FeCl3與SO2首先發生反應(i),說明反應(i)比反應(ii)快,則活化能:E(i)<E(ii);反應最終得到Fe2+,說明反應(ii)進行的程度更大,則平衡常數:K(i)<K(ii)。
故答案為:<;<;
⑤該實驗先滴加2滴濃鹽酸,使反應(ii)加快,說明增強FeCl3溶液的酸性能使氧化還原反應(ii)加快,
故答案為:增強FeCl3溶液的酸性。


科目:高中化學 來源: 題型:
【題目】(1)浙江大學用甲醇、CO、O2在常壓、某溫度和催化劑的條件下合成碳酸二甲酯(CH3OCOOCH3)的研究開發。已知:
①1mol CO完全燃燒放出283.0kJ的熱量;
②1mol H2O(l)完全蒸發變成H2O(g)需吸收44.0 kJ的熱量;
③2CH3OH(g)+CO2(g) ![]() CH3OCOOCH3(g)+H2O(g) ΔH=-15.5 kJ·mol-1
CH3OCOOCH3(g)+H2O(g) ΔH=-15.5 kJ·mol-1
則2CH3OH(g)+CO(g)+1/2O2(g)![]() CH3OCOOCH3(g)+H2O(l) ΔH=__________。
CH3OCOOCH3(g)+H2O(l) ΔH=__________。
(2)工業合成氨的反應為N2(g)+3H2(g)![]() 2NH3(g)是一個放熱的可逆反應,反應條件是高溫、高壓并且需要合適的催化劑。已知形成1mol H—H鍵、1mol N—H鍵、1mol N≡N鍵放出的能量分別為436 kJ、391 kJ、946 kJ。則:
2NH3(g)是一個放熱的可逆反應,反應條件是高溫、高壓并且需要合適的催化劑。已知形成1mol H—H鍵、1mol N—H鍵、1mol N≡N鍵放出的能量分別為436 kJ、391 kJ、946 kJ。則:
①若1 mol氮氣完全反應生成氨氣可放出的能量為__________kJ。
②如果將1 mol氮氣和3 mol氫氣混合,使充分反應,反應放出的能量總小于上述數值,為什么?__________。
③實驗室模擬工業合成氨時,在容積為2L的密閉容器內,反應經過10分鐘后,生成10 mol 氨氣,則用氮氣表示的化學反應速率是__________mol·L-1·min-1。
④一定條件下,當合成氨的反應達到化學平衡時,下列說法正確的是__________。
a.以同一物質表示的正反應速率和逆反應速率相等
b.正反應速率最大,逆反應速率為0
c.氮氣的轉化率達到最大值
d.氮氣和氫氣的濃度相等
e.N2、H2和NH3的體積分數相等
f.反應達到最大限度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯化亞銅是化工和印染等行業的重要原料,廣泛用作有機合成的催化劑。
Ⅰ.甲采用CuCl2·2H2O熱分解法制備CuCl,裝置如圖。

(1)儀器X的名稱是_______________,C中燒杯的試劑可以是__________。
(2)“氣體入口”通入的氣體是_______。
(3)反應結束后,取所得產品分析,發現其中含有氧化銅,其可能原因是______________。
Ⅱ.乙另取純凈CuCl2固體用如下方法制備CuCl。

(4)操作②中反應的離子方程式為___________________。
(5)操作①中若用100 mL 10 mol/L鹽酸代替0.2 mol/L鹽酸,再通入SO2后,無白色沉淀產生。對此現象有如下兩種猜想:
猜想一:c(H+)過大導致白色沉淀溶解。為驗證此猜想,取75gCuCl2固體、100 mL0.2 mol/L鹽酸及________mL10.0mol/LH2SO4配制成200 mL溶液,再進行操作②,觀察是否有白色沉淀產生。
猜想二:_______________。請設計實驗說明該猜想是否成立:_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃下,現有0.1mol·L-1的H2SO4和0.1 mol·L-1一元弱酸HA兩種溶液。
(1)寫出0.1 mol·L-1一元弱酸HA的電離方程式___________________。
(2)0.1mol·L-1的H2SO4中水電離出的C(H+)為_____________________。
(3)向0.1mol·L-1的硫酸中加入一定體積的pH=13的NaOH溶液,反應后溶液的pH為2,則所需NaOH溶液與硫酸的體積比為___________________;
(4)向0.1 mol·L-1一元弱酸HA加入一定體積的水,在此過程中,下列數值變大的是_________________。
①c(H+) ②n(A-) ③c(OH-) ④ Ka ⑤c(A-)/ c(HA)
(5)實驗室在配制溶液時,一些物質存在水解的情況,在配制Fe2(SO4)3溶液時,Fe3+也存在水解,請書寫水解離子方程式____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NiSO4![]() 6H2O易溶于水,其溶解度隨溫度升高明顯增大。以電鍍廢渣(主要成分是NiO,還有CuO、FeO等少量雜質)為原料制備該晶體的流程如下,下列說法錯誤的是
6H2O易溶于水,其溶解度隨溫度升高明顯增大。以電鍍廢渣(主要成分是NiO,還有CuO、FeO等少量雜質)為原料制備該晶體的流程如下,下列說法錯誤的是
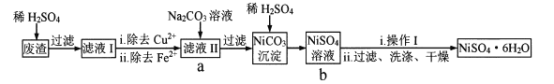
A. 溶解廢渣時不能用稀鹽酸代替稀H2SO4B. 除去Cu2+可采用FeS
C. 流程中a-b的目的是富集NiSO4D. “操作I”為蒸發濃縮、冷卻結晶
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定條件下,在容積為2L的密閉容器中,將2 mol 氣體M和3 mol N氣體混合,發生如下反應:2M(g) + 3N(g) ![]() x Q(g) +3R(g),該反應達平衡時,生成2.4mol R,并測得Q的濃度為0.4 mol/L,下列有關敘述正確的是
x Q(g) +3R(g),該反應達平衡時,生成2.4mol R,并測得Q的濃度為0.4 mol/L,下列有關敘述正確的是
A. x值為2 B. 混合氣體的密度增大
C. N的轉化率為20% D. 平衡時N的濃度為0.3 mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,向濃度均為 0.1 molL-1、體積均為 100 mL 的兩種一元酸 HX、HY的溶液中,分別加入 NaOH固體,lg[c(H+ )/c(OH- )]隨加入 NaOH的物質的量的變化如圖所示。下列說法正確的是

A. 常溫下電離常數:HX < HY![]()
B. a 點由水電離出的 c(H+)=10-12 molL-1
C. c 點溶液中:c(Y- )>c(HY )![]()
D. b 點時酸堿恰好完全中和
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列事實不能用勒夏特列原理來解釋的是
A. 用排飽和食鹽水的方法收集氯氣
B. 加入催化劑使N2和H2在一定條件下生成氨氣
C. 增大壓強,有利于SO2和O2反應生成SO3
D. 在Fe3+ + 3SCN- ![]() Fe(SCN)3反應達平衡時,增加KSCN的濃度,體系顏色變深
Fe(SCN)3反應達平衡時,增加KSCN的濃度,體系顏色變深
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于有機物(![]() )的結構、性質有關的敘述正確的是
)的結構、性質有關的敘述正確的是
A. 該物質所有原子可能在同一平面
B. 與該物質具有相同官能團的芳香烴同分異構體有2種
C. 該物質在一定條件下能發生加成反應、氧化反應、取代反應、加聚反應
D. 1mol該物質最多可與1moBr2反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com