
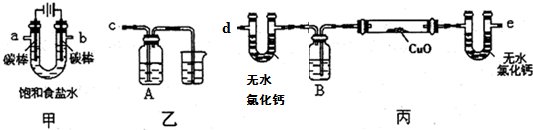
分析 (1)電解飽和氯化鈉溶液時,陰極上氫離子放電,陽極上氯離子放電,同時生成氫氧化鈉;用還原性物質檢驗氯氣,用氧化銅檢驗氫氣;
(2)①氯氣有強氧化性,應該用強還原性的物質檢驗且反應現象明顯,因為氯氣有毒,所以不能直接排空,要有尾氣處理裝置;
②氫氣在還原氧化銅之前要排盡裝置內空氣,否則會產生安全事故;
(3)根據質量差是否與銅有關來分析判斷;利用差量法來計算銅的相對原子質量表達式;根據銅的相對原子質量的表達式確定影響高低.
解答 解:(1)電解飽和食鹽水時,陽極上氯離子放電生成氯氣,陰極上氫離子放電生成氫氣,溶液中同時生成氫氧根離子,所以電解反應離子方程式為2Cl-+2H2O$\frac{\underline{\;通電\;}}{\;}$2OH-+H2↑+Cl2↑,要檢驗氯氣的氧化性,則氯氣連接強還原性的物質且反應現象要明顯,故選c,用氫氣還原氧化銅來檢驗氫氣,因為電解得到的氫氣中含有水蒸氣,所以在實驗前要除去水蒸氣,故選e,
故答案為:2Cl-+2H2O$\frac{\underline{\;通電\;}}{\;}$2OH-+H2↑+Cl2↑;e;c;
(2)①氯氣有毒,不能直接排空,氯氣和水反應生成酸,所以氯氣可以用堿性物質來處理,所以裝置乙燒杯中液體的作用是吸收多余的氯氣,防止環境污染;
氯氣具有強氧化性,能氧化強還原性的物質,要檢驗氯氣,必須選用強還原性的物質且反應現象明顯,
a.氯氣能氧化碘而使溶液褪色,氯氣和水反應生成的次氯酸也能使溶液褪色,所以無法證明氯氣的氧化性,故不選;
b.氯氣和氫氧化鈉溶液反應生成氯化鈉和次氯酸鈉,反應現象不明顯,故不選;
c.氯氣能把亞鐵離子氧化成三價鐵離子,鐵離子和硫氰化鉀溶液反應生成血紅色溶液,反應現象明顯,且能檢驗氯氣的氧化性,故選;
d.氯氣能氧化亞硫酸鈉生成硫酸鈉,但反應前后溶液顏色不變,反應現象不明顯,故不選;
故答案為:吸收多余的氯氣,防止環境污染;c;
②氫氣是可燃性氣體,與氧氣混合,加熱容易發生爆炸危險,加熱氧化銅之前要通入氫氣排盡裝置內空氣,故答案為:通入氫氣排盡裝置內空氣;
(3)①中質量的差量是氫氣還原氧化銅得到的物質,與銅有關,所以能計算銅的相對原子質量,②中質量的差量是氫氣中原來的水蒸氣,與銅無關,所以不能計算銅的相對原子質量,故選①;
硬質玻璃管中的質量差是氧元素的質量=m-m3,
設銅的相對原子質量為x,
CuO------O
1 16
$\frac{m}{x+16}$ m-m3
x=$\frac{16{m}_{3}}{m-{m}_{3}}$,
反應生成的銅被空氣的氧氣氧化使m3數據增大,則$\frac{16{m}_{3}}{m-{m}_{3}}$偏大,所以導致測定結果偏大,
故答案為:①;$\frac{16{m}_{3}}{m-{m}_{3}}$;偏大;反應生成的銅被空氣的氧氣氧化使m3數據增大,導致測定結果偏大.
點評 本題考查實驗探究,難點是(3)題中確定影響銅的相對原子質量的大小,根據$\frac{16{m}_{3}}{m-{m}_{3}}$來分析即可,題目難度中等.


 名師導航單元期末沖刺100分系列答案
名師導航單元期末沖刺100分系列答案科目:高中化學 來源: 題型:選擇題
| A. | D的濃度減小了 | B. | A的轉化率減小了 | ||
| C. | 物質B的質量分數增加了 | D. | a+b>c+d |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 平衡時,v正(O2)=v逆(O2)=0必成立 | |
| B. | 關系式5v正(O2)=4v正(NO)總成立 | |
| C. | 在同一段時間范圍內,用上述四種物質NH3、O2、NO、H2O的變化表示正反應速率的數值中,v正(H2O)最大 | |
| D. | 若投入4 mol NH3和5 mol O2,通過控制外界條件,必能生成4 mol NO |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向裝置中通入氮氣且保持體積不變 | |
| B. | 向裝置中通入稍過量氧氣且保持體積不變 | |
| C. | 添加更多的催化劑 | |
| D. | 降低溫度,及時轉移SO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用X表示此反應的反應速率是0.1amol•L-1•min-1 | |
| B. | 當混合氣體的壓強不再發生變化時,說明反應達到平衡狀態 | |
| C. | 向平衡后的體系中加入1 mol M,平衡向逆反應方向移動 | |
| D. | 向上述平衡體系中再充入1 mol X,v正增大,v逆減小,平衡正向移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 按系統命名法,化合物 的名稱為:2,6-二甲基-5-乙基庚烷 的名稱為:2,6-二甲基-5-乙基庚烷 | |
| B. | 丙氨酸和苯丙氨酸脫水,最多可生成3種二肽 | |
| C. | 大氣污染物氟利昂-12的化學式是CF2Cl2具有正四面體結構 | |
| D. | 三硝酸甘油酯的分子式為C3H5N3O9 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在氧化還原反應中,甲比乙失電子多 | |
| B. | 同價態陽離子,甲比乙的氧化性強 | |
| C. | 甲能與冷水反應而乙不能 | |
| D. | 將甲、乙組成原電池時,乙為負極 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 用物質 A 表示的反應的平均速率為 0.3 mol•L-1•s-1 | |
| B. | 用物質 B 表示的反應的平均速率為 0.6 mol•L-1•s-1 | |
| C. | 2 s 時物質 A 的轉化率為70% | |
| D. | 2 s 時物質 B 的濃度為 0.7 mol•L-1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com