
| A. | D的濃度減小了 | B. | A的轉化率減小了 | ||
| C. | 物質B的質量分數增加了 | D. | a+b>c+d |
分析 先假設體積增加一倍時若平衡未移動,B的濃度應為原來的50%,實際平衡時B的濃度是原來的60%,比假設大,說明平衡向生成B的方向移動,即減小壓強平衡向逆反應方向移動,則a+b>c,據此結合選項判斷.
解答 解:先假設體積增加一倍時若平衡未移動,B的濃度應為原來的50%,實際平衡時B的濃度是原來的60%,比假設大,說明平衡向生成B的方向移動,即減小壓強平衡向逆反應方向移動,則a+b>c,
A.D為固體,D的濃度不變,故A錯誤;
B.由分析可知,平衡向逆反應移動,A的轉化率減小,故B正確;
C.平衡向逆反應移動,氣體的總質量增大,B的質量也增大,所以不能判斷B的質量分數是否增大,故C錯誤;
D.由分析可知,減小壓強平衡向逆反應方向移動,則a+b>c,但是a+b與c+d的關系不能確定,故D錯誤;
故選B.
點評 本題考查了壓強對化學平衡移動的影響,題目難度不大,注意通過改變體積引起濃度的變化判斷平衡移動的方向,此為解答該題的關鍵.


 名師點撥卷系列答案
名師點撥卷系列答案 英才計劃期末調研系列答案
英才計劃期末調研系列答案科目:高中化學 來源: 題型:選擇題
| A. | CO+H2O$\frac{\underline{\;高溫\;}}{\;}$H2+CO2 | B. | CaCO3+H2O+CO2═Ca(HCO3)2 | ||
| C. | CuO+2HCl═CuCl2+H2O | D. | CaCO3$\frac{\underline{\;\;△\;\;}}{\;}$CaO+CO2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
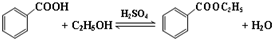
| 沸點(℃) | 密度(g•cm-3) | |
| 苯甲酸 | 249 | 1.2659 |
| 苯甲酸乙酯 | 212.6 | 1.05 |
| 乙醇 | 78.5 | 0.7893 |
| 環己烷 | 80.8 | 0.7785 |
| 乙醚 | 34.51 | 0.7318 |
| 環己烷、乙醇和水共沸物 | 62.1 |

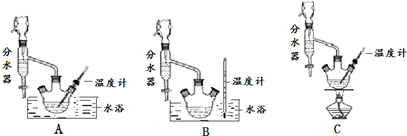
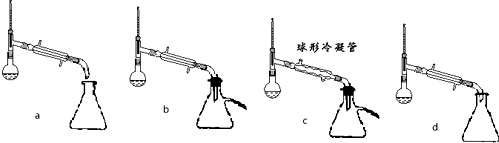
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
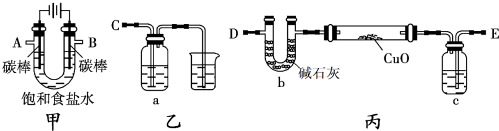
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com