
| A. | 平衡時,v正(O2)=v逆(O2)=0必成立 | |
| B. | 關系式5v正(O2)=4v正(NO)總成立 | |
| C. | 在同一段時間范圍內,用上述四種物質NH3、O2、NO、H2O的變化表示正反應速率的數值中,v正(H2O)最大 | |
| D. | 若投入4 mol NH3和5 mol O2,通過控制外界條件,必能生成4 mol NO |
分析 A.可逆反應屬于動態平衡,平衡時正、逆反應速率相等但不為0;
B.速率之比等于化學計量數之比;
C.速率之比等于化學計量數之比;
D.可逆反應中反應物不能全部轉化為生成物.
解答 解:A.可逆反應屬于動態平衡,平衡時同種物質的生成速率與消耗速率相等但不為0,故A錯誤;
B.速率之比等于化學計量數之比,則4v正(O2)=5v正(NO),故B錯誤;
C.在同一段時間范圍內,用上述四種物質NH3、O2、NO、H2O的變化表示正反應速率的數值中,由于H2O的計量數最大,所以v正(H2O)最大,故C正確;
D.可逆反應中反應物不能全部轉化為生成物,則投入4 mol NH3和5 mol O2,不論怎樣控制外界條件,生成NO的物質的量一定小于4 mol,故D錯誤,
故選:C.
點評 本題考查化學平衡狀態特征、可逆反應的特點、反應速率與計量數的關系等,題目難度不大,注意把握同一反應中速率之比等于化學計量數之比.


 舉一反三單元同步過關卷系列答案
舉一反三單元同步過關卷系列答案科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
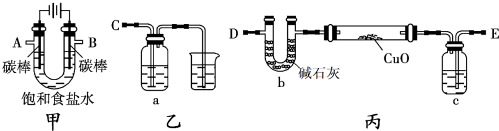
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
 硫酸工業的生產工藝流程可簡略表示如下:
硫酸工業的生產工藝流程可簡略表示如下: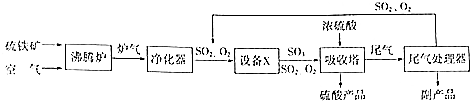 請回答下列問題:
請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 使用合適的催化劑可以加大反應速率 | |
| B. | 升高溫度可以增大反應速率 | |
| C. | 無論如何增大H2濃度,都不能使N2轉化率達到100% | |
| D. | 縮小體積,υ正增大,υ逆減小,平衡正向移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
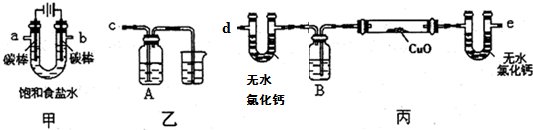
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com