
 $→_{85℃}^{濃H_{2}SO_{4}}$
$→_{85℃}^{濃H_{2}SO_{4}}$

| 密度(g•cm-3) | 熔點(℃) | 沸點(℃) | 溶解性 | |
| 環己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 環己烯 | 0.81 | -103 | 83 | 難溶于水 |
分析 以醇與濃硫酸混合加熱制烯烴的反應原理為基礎制備環己烯的流程,實驗過程包括液體混合物加熱、相互混溶液體混合物的分離提純的基本實驗操作,涉及液體混合物加熱防暴沸、蒸汽的冷凝及蒸餾操作冷卻水的水流方向等操作注意點,另外還探究了影響產率的因素,
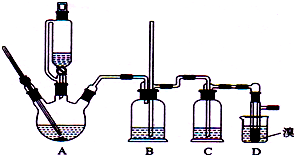
(1)①根據制乙烯實驗的知識,發生裝置A中碎瓷片的作用是防止暴沸;
②由于生成的環己烯的沸點為83℃,要得到液態環己烯,導管B除了導氣外還具有冷凝作用,便于環己烯冷凝;
(2)①分液后環己烯粗品中還含有少量的酸和環己醇,根據所提供物質的性質分析;
②為了使冷凝的效果更好,冷卻水從冷凝管的下口進入,上口出;生石灰能與水反應生成氫氧化鈣;
③根據表中數據可知,餾分環己烯的沸點為83℃;
a、若提前收集,產品中混有雜質,實際產量高于理論產量;
b、制取的環己烯物質的量增大,實驗制得的環己烯精品質量高于理論產量;
c、粗產品中混有環己醇,導致測定消耗的環己醇量增大,制得的環己烯精品質量低于理論產量;
解答 解:以醇與濃硫酸混合加熱制烯烴的反應原理為基礎制備環己烯的流程,實驗過程包括液體混合物加熱、相互混溶液體混合物的分離提純的基本實驗操作,涉及液體混合物加熱防暴沸、蒸汽的冷凝及蒸餾操作冷卻水的水流方向等操作注意點,另外還探究了影響產率的因素,
(1)①根據制乙烯實驗的知識,發生裝置A中碎瓷片的作用是防止暴沸,
故答案為:防止液體暴沸;
②由于生成的環己烯的沸點為83℃,要得到液態環己烯,導管B除了導氣外還具有冷凝作用,便于環己烯冷凝,
故答案為:冷凝;
(2)①由于分液后環己烯粗品中還含有少量的酸和環己醇,聯想制備乙酸乙酯提純產物時用c(Na2CO3溶液)洗滌可除去酸,不能用酸性高錳酸鉀,否則會氧化環己烯,
故選:c;
②為了使冷凝的效果更好,冷卻水從冷凝管的下口即g口進入;生石灰能與水反應生成氫氧化鈣,除去了殘留的水,得到純凈的環己烯;
故答案為:g;除去環己烯中少量的水;
③根據表中數據可知,餾分環己烯的沸點為83℃,故收集產品應控制溫度在83℃左右;
a、蒸餾時從70℃開始收集產品,提前收集,產品中混有雜質,實際產量高于理論產量,故a錯誤;
b、環己醇實際用量多了,制取的環己烯的物質的量增大,實驗制得的環己烯精品質量高于理論產量,故b錯誤;
c、若粗產品中混有環己醇,導致測定消耗的環己醇量增大,制得的環己烯精品質量低于理論產量,故c正確;,故選c;
故答案為:83℃;c.
點評 本題以有機合成為載體綜合考查了實驗室制環己烯的知識,考查了學生運用知識的能力,題目難度中等,注意把握實驗原理和方法,特別是實驗的基本操作,學習中注意積累.


 海淀黃岡名師導航系列答案
海淀黃岡名師導航系列答案 普通高中同步練習冊系列答案
普通高中同步練習冊系列答案 優翼小幫手同步口算系列答案
優翼小幫手同步口算系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 實驗室制備1,2-二溴乙烷的反應原理如下:
實驗室制備1,2-二溴乙烷的反應原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 狀態 | 無色液體 | 無色液體 | 無色液體 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸點/℃ | 78.5 | 132 | 34.6 |
| 熔點/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com