
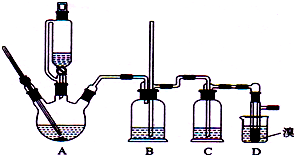
 實驗室制備1,2-二溴乙烷的反應原理如下:
實驗室制備1,2-二溴乙烷的反應原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 狀態 | 無色液體 | 無色液體 | 無色液體 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸點/℃ | 78.5 | 132 | 34.6 |
| 熔點/℃ | 一l30 | 9 | -1l6 |
分析 (1)乙醇在濃硫酸140℃的作用下發生分子間脫水生成乙醚,同時反應溫度過高,乙醇被濃硫酸氧化,乙烯通入的流速過快反應不充分都會導致1,2-二溴乙烷的產量比理論值低;
(2)乙烯和溴水發生了加成反應,溴水會褪色;
(3)1,2-二溴乙烷在氫氧化鈉溶液中可能水解,碳酸鈉溶液呈堿性,也可以吸收Br2,據此答題;
(4)根據1,2-二溴乙烷和水的密度相對大小解答;
(5)利用1,2-二溴乙烷與乙醚的沸點不同進行解答;
(6)裝置D若使用冰水冷卻,1,2-二溴乙烷變成固態,會導致導管堵塞;
(7)根據實驗裝置圖可知,實驗中有少量的未反應的溴會污染空氣,要有尾氣吸收裝置.
解答 解:(1)乙醇在濃硫酸140℃的作用下發生分子間脫水生成乙醚,同時反應溫度過高,乙醇被濃硫酸氧化,乙烯通入的流速過快反應不充分都會導致1,2-二溴乙烷的產量比理論值低,
故答案為:A中反應溫度沒有迅速升高到170℃,部分乙醇生成了乙醚; A中反應溫度過高,乙醇被濃硫酸氧化,生成乙烯的物質的量偏少;A中反應反應速率過快,導致乙烯通入的流速過快反應不充分;
(2)乙烯和溴水發生加成反應生成1,2-二溴乙烷,1,2-二溴乙烷為無色,所以當溴的顏色完全褪去時,說明反應已經結束,
故答案為:溴的顏色完全褪去;
(3)1,2-二溴乙烷在氫氧化鈉溶液中可能水解,碳酸鈉溶液呈堿性,也可以吸收Br2,所以可以用飽和碳酸鈉溶液洗滌,
故答案為:d;
(4)1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大,
故答案為:下;1,2-二溴乙烷的密度大于水;
(5)1,2-二溴乙烷與乙醚的沸點不同,兩者均為有機物,互溶,用蒸餾的方法將它們分離時,1,2-二溴乙烷的沸點132℃大于乙醚的沸點34.6℃,乙醚以氣態被分離出去,
故答案為:1,2-二溴乙烷的沸點132℃大于乙醚的沸點34.6℃,乙醚以氣態被分離出去;
(6)裝置D若使用冰水冷卻,1,2-二溴乙烷變成固態,會導致導管堵塞,此時裝置B中玻璃導管中的液面會升高,甚至溢出,
故答案為:玻璃導管中的液面會升高,甚至溢出;
(7)根據實驗裝置圖可知,實驗中有少量的未反應的溴會污染空氣,要有尾氣吸收裝置,而本實驗中沒有,
故答案為:缺乏尾氣處理裝置.
點評 該題較為綜合,主要考查了乙醇制備1,2-二溴乙烷,掌握相關物質的基本化學性質,是解答本題的關鍵,平時須注意積累相關反應知識,難度中等.


 口算題天天練系列答案
口算題天天練系列答案科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr
+HBr查看答案和解析>>
科目:高中化學 來源: 題型:解答題


查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 $→_{85℃}^{濃H_{2}SO_{4}}$
$→_{85℃}^{濃H_{2}SO_{4}}$

| 密度(g•cm-3) | 熔點(℃) | 沸點(℃) | 溶解性 | |
| 環己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 環己烯 | 0.81 | -103 | 83 | 難溶于水 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
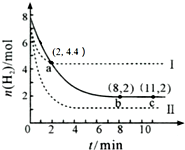
| A. | 該溫度下,a點時,3 v正(CO2)=v正(H2) | |
| B. | 曲線Ⅱ對應的條件改變可能是充入氦氣 | |
| C. | 曲線Ⅰ對應的條件改變可能是降低溫度 | |
| D. | 從反應開始至a點,v (CO2)=0.6 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| t/s | 0 | 5 | 15 | 25 | 35 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
| A. | 反應在前5s的平均速率v(A)=0.17mol•L-1•s-1 | |
| B. | 保持其他條件不變,升高溫度,平衡時c(A)=0.41mol•L-1,則反應的△H>0 | |
| C. | 相同溫度下,起始時向容器中充入2.0mol C,達到平衡時,C的轉化率大于80% | |
| D. | 相同溫度下,起始時向容器中充入0.20mol A、0.20mol B和1.0mol C,反應達到平衡前v(正)<v(逆) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 容器內壓強不再隨時間變化 | |
| B. | 混合氣體的顏色不再改變 | |
| C. | I2與H2在混合氣體中的體積分數相等 | |
| D. | H2、I2、HI的濃度相等 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com