
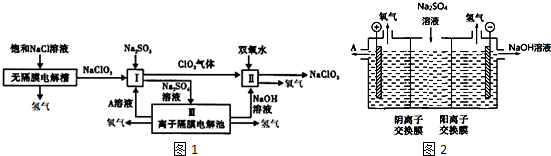
分析 根據工藝流程圖用有離子隔膜的電解槽電解Na2SO4溶液,可知氣體a為O2,該極為陽極,OH-放電,c(H+)增大,SO42-移向該極,所以A為硫酸溶液,Ⅰ中氯酸鈉、亞硫酸鈉和稀硫酸反應生成二氧化氯和硫酸鈉,Ⅱ中發(fā)生二氧化氯與雙氧水在堿性條件下反應生成NaClO2和氧氣;
(1)根據工藝流程圖無隔膜電解槽陽極發(fā)生氧化反應生成氯酸根離子;
(2)解槽電解Na2SO4溶液,可知氣體a為O2,該極為陽極,OH-放電,c(H+)增大,SO42-移向該極,所以A為硫酸溶液;
(3)Ⅱ中發(fā)生二氧化氯與雙氧水在堿性條件下反應生成NaClO2和氧氣,根據電子得失守恒分析配平;
(4)設備Ⅲ在通電電解前,檢驗其溶液中主要陰離子是硫酸根離子,SO42-的檢驗方法:用稀鹽酸和氯化鋇溶液檢驗.
解答 解:(1)根據工藝流程圖無隔膜電解槽陽極發(fā)生氧化反應生成氯酸根離子,所以電極反應式為Cl-+3H2O-6e-=ClO3-+6H+,故答案為:Cl-+3H2O-6e-=ClO3-+6H+; (2)解槽電解Na2SO4溶液,可知氣體a為O2,該極為陽極,OH-放電,c(H+)增大,SO42-移向該極,所以A為硫酸溶液,故答案為:H2SO4;
(3)Ⅱ中發(fā)生二氧化氯與雙氧水在堿性條件下反應生成NaClO2和氧氣,所以方程式為:2ClO2+H2O2+2OH-=2ClO2-+O2+2H2O,故答案為:2ClO2+H2O2+2OH-=2ClO2-+O2+2H2O;
(4)電解前Ⅲ中陰離子為SO42-,SO42-的檢驗方法:取少量Ⅲ中溶液少許于試管中,先加入足量稀鹽酸,無沉淀生成,再加入BaCl2溶液,產生白色沉淀,證明含有SO42-;
故答案為:取少量Ⅲ中溶液少許于試管中,先加入足量稀鹽酸,無沉淀生成,再加入BaCl2溶液,產生白色沉淀,證明含有SO42-.
點評 本題以亞氯酸鈉(NaClO2)的生產流程為情境,主要考查電解原理、氧化還原反應、離子方程式的書寫、SO42-的檢驗等知識點,主要通過工藝流程考查學生分析問題、解決問題的能力,題目難度中等.


 各地期末復習特訓卷系列答案
各地期末復習特訓卷系列答案 小博士期末闖關100分系列答案
小博士期末闖關100分系列答案科目:高中化學 來源: 題型:選擇題
| A. | NO(NO2):通過裝有水的洗氣裝置 | |
| B. | Cu粉(鐵粉):加足量稀硝酸,過濾 | |
| C. | NH3(H2O):通過裝有濃硫酸的洗氣裝置 | |
| D. | KCl(CaCl2):加適量Na2CO3溶液,過濾 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 序號 | 電壓/V | 陽極現象 | 檢驗陽極產物 |
| Ⅰ | x≥a | 電極附近出現黃色,有氣泡產生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 電極附近出現黃色,無氣泡產生 | 有Fe3+、無Cl2 |
| Ⅲ | b>x>0 | 無明顯變化 | 無Fe3+、無Cl2 |
| 序號 | 電壓/V | 陽極現象 | 檢驗陽極產物 |
| Ⅳ | a>x≥c | 無明顯變化 | 有Cl2 |
| Ⅴ | c>x≥b | 無明顯變化 | 無Cl2 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 提高高錳酸鉀的氧化能力,用鹽酸酸化 | |
| B. | 抑制Fe2+的水解,用稀硝酸酸化 | |
| C. | 檢驗某氯代烷烴中含氯元素,加堿溶液加熱后用稀硝酸酸化,再加硝酸銀溶液檢驗 | |
| D. | 確認某溶液中含有SO42-時,先加入鹽酸酸化,再加氯化鋇溶液檢驗 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溫度 | 元素存在形式 |
| 1200-1350K | Fe3+部分轉變?yōu)镕e2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗編號 | 溫度(℃) | 大理石規(guī)格 | HNO3濃度(mol/L) | 實驗目的 |
| ① | 25 | 粗顆粒 | 2.00 | (Ⅰ)實驗①和②探究濃度對反應速率的影響;(Ⅱ)實驗①和③探究溫度對反應速率的影響;(Ⅲ)實驗①和④探究大理石規(guī)格(粗、細)對反應速率的影響. |
| ② | ||||
| ③ | ||||
| ④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 周期表是按各元素的相對原子質量遞增的順序從左到右排列的 | |
| B. | 元素周期表共有16個族,也就是16個縱行 | |
| C. | 同周期元素的電子層數相同 | |
| D. | 每一周期的元素都是從堿金屬開始,以稀有氣體結束 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com