
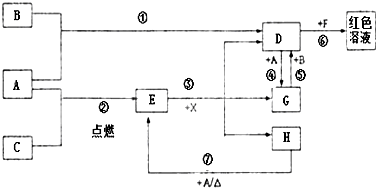
 A、B、C為中學常見單質,其中一種為金屬;通常情況下A為固體、B為黃綠色氣體、C為無色氣體.D、E、F、G、H、X均為化合物,其中X常溫下是無色氣體,其水溶液是一種無氧強酸溶液,E為黑色固體,H在常溫下為液體.它們之間的轉化如圖所示(某些反應條件和部分反應產物已略去).
A、B、C為中學常見單質,其中一種為金屬;通常情況下A為固體、B為黃綠色氣體、C為無色氣體.D、E、F、G、H、X均為化合物,其中X常溫下是無色氣體,其水溶液是一種無氧強酸溶液,E為黑色固體,H在常溫下為液體.它們之間的轉化如圖所示(某些反應條件和部分反應產物已略去).分析 單質A和C反應生成E為黑色晶體,E黑色固體和X酸反應生成D、G、H,其中DG之間可以實現相互轉化,說明A為變價金屬Fe,和C在點燃條件下生成黑色固體E為Fe3O4,C為O2,依據D+A=G說明D為含三價鐵離子的化合物,F為含硫氰酸根離子的化合物,G為含Fe2+離子的化合物,H為H2O;依據G+B=D分析判斷B是強氧化劑,B為黃綠色氣體,證明為Cl2,所以推斷D為FeCl3,得到G為FeCl2;X為HCl;依據判斷出的物質回答問題.
解答 解:單質A和C反應生成E為黑色晶體,E黑色固體和X酸反應生成D、G、H,其中DG之間可以實現相互轉化,說明A為變價金屬Fe,和C在點燃條件下生成黑色固體E為Fe3O4,C為O2,依據D+A=G說明D為含三價鐵離子的化合物,F為含硫氰酸根離子的化合物,推斷為KSCN溶液,G為含Fe2+離子的化合物,H為H2O;依據G+B=D分析判斷B是強氧化劑,B為黃綠色氣體,證明為Cl2,所以推斷D為FeCl3,得到G為FeCl2;X為HCl;
(1)依據分析推斷可知,D為FeCl3,X為HCl,
故答案為:FeCl3;HCl;
(2)依據反應過程分析,①為鐵和氯氣發生的氧化還原反應,②為鐵和氧氣發生的氧化還原反應,③為四氧化三鐵和鹽酸發生的復分解反應,不是氧化還原反應,④為氯化鐵和鐵發生的氧化還原反應,⑤為氯化亞鐵和氯氣發生的氧化還原反應,⑥是氯化鐵和硫氰酸鹽發生的復分解反應,不是氧化還原反應,
故答案為:③⑥;
(3)反應⑥是氯化鐵和硫氰酸鹽發生的復分解反應,反應的離子方程式為:Fe3++3SCN-=Fe(SCN)3,
故答案為:Fe3++3SCN-=Fe(SCN)3;
(4)往G為FeCl2溶液中加入NaOH溶液觀察到的現象是,生成白色氫氧化亞鐵沉淀,被空氣中氧氣氧化為氫氧化鐵,現象為生成白色沉淀,迅速變為灰綠色,最終變為紅褐色,
故答案為:生成白色沉淀,迅速變為灰綠色,最終變為紅褐色;
(5)反應⑦是鐵在水蒸氣中發生的反應生成四氧化三鐵和氫氣,反應的化學方程式為:3Fe+4H2O(g)$\frac{\underline{\;高溫\;}}{\;}$Fe3O4+4H2;該反應中符合氧化還原反應的電子守恒,氫元素化合價從+1價變化為0價,4H2O反應轉移電子為 8mol,鐵元素從0價變化為+$\frac{8}{3}$價,每消耗 0.3mol的A(Fe),可轉移電子0.8mol,
故答案為:3Fe+4H2O(g)$\frac{\underline{\;高溫\;}}{\;}$Fe3O4+4H2;0.8.
(6)除去FeCl3溶液中混有的少量FeCl2的方法是:向混合溶液中通入足量的氯氣,
故答案為:向混合溶液中通入足量的氯氣.
點評 本題考查了物質轉化關系的分析判斷,物質性質的應用,反應現象和反應條件的應用是解題關鍵,主要考查鐵及其化合物性質的應用,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 升高溫度,正反應速率增大,化學平衡常數增大 | |
| B. | 減小壓強,逆反應速率減小,化學平衡常數減小 | |
| C. | 加入催化劑,正逆反應速率不變,平衡不移動 | |
| D. | 充入氧氣,正反應速率先增大后減小,平衡向正反應方向移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 5 種 | B. | 6 種 | C. | 7 種 | D. | 8 種 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,11.2 L CO和CO2混合氣體中含有的碳原子數目為0.5NA | |
| B. | 標準狀況下,7.1 g氯氣與足量氫氧化鈉溶液反應轉移的電子數為2NA | |
| C. | 92 g NO2和N2O4的混合氣體中含有的原子總數為6NA | |
| D. | 100 g 17%的氨水,溶液中含有的NH3分子數為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
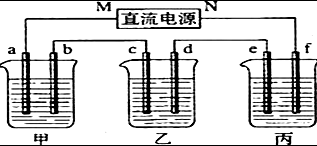 如圖所示裝置中,甲、乙、丙三個燒杯依次分別盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和l00g 10.00%的K2SO4溶液.電極均為石墨電極.
如圖所示裝置中,甲、乙、丙三個燒杯依次分別盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和l00g 10.00%的K2SO4溶液.電極均為石墨電極.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 最終得到7.8g的沉淀 | |
| B. | 反應過程中得到6.72L(標準狀況)的氣體 | |
| C. | 最終得到的溶液中c(NaCl)=2.0mo/L | |
| D. | 最終得到的溶液中Al元素都以Al(OH)3形式存在 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com