
| A. | 最終得到7.8g的沉淀 | |
| B. | 反應過程中得到6.72L(標準狀況)的氣體 | |
| C. | 最終得到的溶液中c(NaCl)=2.0mo/L | |
| D. | 最終得到的溶液中Al元素都以Al(OH)3形式存在 |
分析 15.6gNa2O2的物質的量為$\frac{15.6g}{78g/mol}$=0.2mol,5.4gAl的物質的量為$\frac{5.4g}{27g/mol}$=0.2mol,首先發生反應2Na2O2+2H2O═4NaOH+O2↑,生成NaOH為0.4mol,再發生2Al+2NaOH+2H2O═2NaAlO2+3H2↑,由方程式可知Al完全反應,剩余NaOH為0.4mol-0.2mol=0.2mol,生成NaAlO2為0.2mol,通入標準狀況下的HCl氣體6.72L,物質的量為$\frac{6.72L}{22.4L/mol}$=0.3mol,首先發生反應NaOH+HCl═NaCl+H2O,剩余HCl為0.3mol-0.2mol=0.1mol,再發生反應NaAlO2+HCl+H2O═Al(OH)3↓+NaCl,由方程式可知,NaAlO2有剩余,HCl完全反應,生成Al(OH)3為0.1mol,最終溶液中溶質為NaAlO2、NaCl.
A.根據m=nM計算生成的氫氧化鋁的質量;
B.根據過氧化鈉與水反應及鋁與氫氧化鈉反應計算生成氧氣、氫氣的總體積;
C.根據Na元素守恒可知反應后溶液中n(Na+)=2n(Na2O2),再根據c=$\frac{n}{V}$計算;
D.Al元素以Al(OH)3、NaAlO2形式存在.
解答 解:15.6gNa2O2的物質的量為$\frac{15.6g}{78g/mol}$=0.2mol,5.4gAl的物質的量為$\frac{5.4g}{27g/mol}$=0.2mol,首先發生反應2Na2O2+2H2O═4NaOH+O2↑,生成NaOH為0.4mol,再發生2Al+2NaOH+2H2O═2NaAlO2+3H2↑,由方程式可知Al完全反應,剩余NaOH為0.4mol-0.2mol=0.2mol,生成NaAlO2為0.2mol,通入標準狀況下的HCl氣體6.72L,物質的量為$\frac{6.72L}{22.4L/mol}$=0.3mol,首先發生反應NaOH+HCl═NaCl+H2O,剩余HCl為0.3mol-0.2mol=0.1mol,再發生反應NaAlO2+HCl+H2O═Al(OH)3↓+NaCl,由方程式可知,NaAlO2有剩余,HCl完全反應,生成Al(OH)3為0.1mol,最終溶液中溶質為NaAlO2、NaCl.
A.最終生成Al(OH)3為0.1mol,質量為0.1mol×78g/mol=7.8g,故A正確;
B.過氧化鈉與水反應生成氧氣為0.2mol×$\frac{1}{2}$=0.1mol,鋁與氫氧化鈉反應生成氫氣為0.2mol×$\frac{3}{2}$=0.3mol,故生成氫氣的體積為(0.1mol+0.3mol)×22.4L/mol=8.96L,故B錯誤;
C.根據Na元素守恒可知,反應后溶液中n(Na+)=2n(Na2O2)=2×0.2mol=0.4mol,故溶液中c(Na+)=$\frac{0.4mol}{0.2L}$=2mol/L,故C錯誤;
D.由上述分析可知,Al元素以Al(OH)3、NaAlO2形式存在,故D錯誤,
故選A.
點評 本題考查混合物的計算、鈉的化合物與鋁單質及化合物的性質等,難度中等,根據過量計算判斷發生的反應是解題的關鍵.


 活力課時同步練習冊系列答案
活力課時同步練習冊系列答案 學業測評一課一測系列答案
學業測評一課一測系列答案科目:高中化學 來源: 題型:解答題
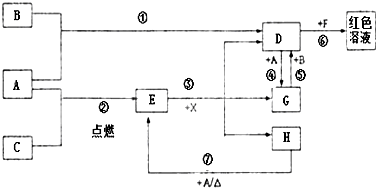 A、B、C為中學常見單質,其中一種為金屬;通常情況下A為固體、B為黃綠色氣體、C為無色氣體.D、E、F、G、H、X均為化合物,其中X常溫下是無色氣體,其水溶液是一種無氧強酸溶液,E為黑色固體,H在常溫下為液體.它們之間的轉化如圖所示(某些反應條件和部分反應產物已略去).
A、B、C為中學常見單質,其中一種為金屬;通常情況下A為固體、B為黃綠色氣體、C為無色氣體.D、E、F、G、H、X均為化合物,其中X常溫下是無色氣體,其水溶液是一種無氧強酸溶液,E為黑色固體,H在常溫下為液體.它們之間的轉化如圖所示(某些反應條件和部分反應產物已略去).查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③ | B. | ②③④ | C. | ③④⑤ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HClO2→ClO2+Cl2+H2O(未配平),1 mol HClO2分解時轉移電子的物質的量為1 mol | |
| B. | 標準狀況下,28 g CO、C2H4混合氣體與22.4 L N2所含有的分子數都是NA | |
| C. | 與金屬Cu常溫下反應放出氣體的溶液可以存在的離子有:Fe2+、Al3+、SO42-、K+ | |
| D. | 在燃煤時加入適量石灰石,可減少SO2的排放,其中發生的反應為:2CaCO3+O2+2SO2$\frac{\underline{\;高溫\;}}{\;}$2CaSO3+2CO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 在稀硫酸、純堿、二氧化碳、銅片、食鹽、生石灰、三氧化鎢、鐵片和木炭粉9種物質中,存在下面的相互關系,選擇①~⑤為適當的物質,使有連線的兩種物質能發生反應.
在稀硫酸、純堿、二氧化碳、銅片、食鹽、生石灰、三氧化鎢、鐵片和木炭粉9種物質中,存在下面的相互關系,選擇①~⑤為適當的物質,使有連線的兩種物質能發生反應.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | FeCO3在空氣中灼燒 | B. | 鋁條插入冷的濃硫酸中 | ||
| C. | Na2O2敞放在空氣中 | D. | 向Mg(OH)2懸濁液中加入FeCl3溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
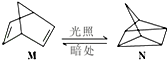
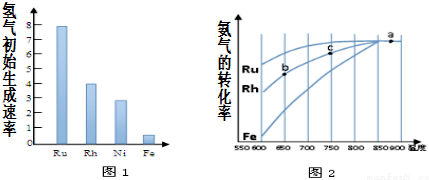
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com