
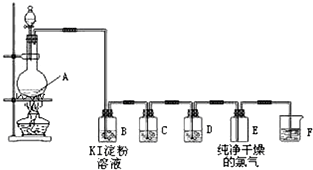
分析 實驗室制取、檢驗和收集純凈干燥的氯氣,由實驗裝置可知,A中發生4HCl(濃)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,B中淀粉KI檢驗氯氣,氯氣氧化KI生成碘,則碘遇淀粉變藍,C中飽和食鹽水除去HCl,D中濃硫酸干燥氯氣,E收集氯氣,F中NaOH溶液吸收尾氣,以此來解答.
解答 解:(1)裝置A中發生二氧化錳與濃鹽酸的反應,化學方程式為4HCl(濃)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,故答案為:4HCl(濃)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)B中淀粉KI檢驗氯氣,現象為無色溶液變成藍色,故答案為:無色溶液變成藍色;
(3)裝置C中所裝試劑是飽和食鹽水,作用是除去HCl,D中所裝試劑是濃硫酸,其作用為除水蒸氣,故答案為:除去HCl;濃硫酸;除水蒸氣;
(4)裝置F是氯氣的尾氣處理裝置,發生反應的化學方程式為Cl2+2NaOH=NaCl+NaClO+H2O,故答案為:Cl2+2NaOH=NaCl+NaClO+H2O.
點評 本題考查氯氣的制備實驗設計,為高頻考點,把握物質的性質、實驗裝置的作用、發生的反應為解答的關鍵,側重分析與實驗能力的考查,題目難度不大.


科目:高中化學 來源: 題型:選擇題

| A. | 12 g C(s)與一定量O2(g)反應生成14 g CO(g)放出的熱量為110.5 kJ | |
| B. | 該反應的熱化學方程式是2C(s)+O2(g)═2CO(g)△H=-221 kJ | |
| C. | 2 mol C(s)與足量O2(g)反應生成CO2(g),放出的熱量大于221 kJ | |
| D. | 該反應的反應熱等于CO分子中化學鍵形成時所釋放的總能量與O2分子中化學鍵斷裂時所吸收的總能量的差 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | C2H2、C6H6 | B. | C2H4、C2H6O | C. | CH2O、C3H6O2 | D. | CH4、C2H4O2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實 驗 操 作 | 現 象 和 結 論 |
| 步驟一:取萃取后的上層清液滴加2滴K4[Fe(CN)6] | 若產生①藍色沉淀, 則②猜想一不成立; |
步驟二:往探究Ⅲ所得溶液中加入少量乙醚,充分振蕩、靜置分層 | 若③乙醚層呈血紅色, 則④猜想二成立; |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 開始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 mol Fe與過量的稀HNO3反應,轉移2 NA個電子 | |
| B. | 常溫常壓下,22.4L的NO2和CO2合氣體含有2 NA個O 原子 | |
| C. | 1 L 0.1 mol•L-1NaHCO3液含有0.1 NA個HCO3- | |
| D. | 常溫下,4gCH4含有NA個C-H共價鍵 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com