
| 實 驗 操 作 | 現 象 和 結 論 |
| 步驟一:取萃取后的上層清液滴加2滴K4[Fe(CN)6] | 若產生①藍色沉淀, 則②猜想一不成立; |
步驟二:往探究Ⅲ所得溶液中加入少量乙醚,充分振蕩、靜置分層 | 若③乙醚層呈血紅色, 則④猜想二成立; |
分析 (1)根據KI和FeCl3和發生反應:2KI+FeCl3=I2+2KCl+FeCl2,液體呈棕黃色;碘單質易溶于四氯化碳,混合液分層,四氯化碳層呈紫紅色;
(2)①根據題目中的信息一和信息二進行解答反應的現象和結論;
②Fe3+可與[Fe(CN)6]4-反應生成藍色沉淀,據此寫出反應的離子方程式.
解答 解:(1)活動(Ⅰ)中發生反應:2KI+FeCl3=I2+2KCl+FeCl2,碘溶于水呈棕黃色;碘單質易溶于有機溶劑四氯化碳,所以CCl4能萃取水中的碘,溶液呈紫紅色,由于CCl4的密度比水大,所以在混合液的下層,
故答案為:溶液呈棕黃色;溶液分層,下層CCl4層呈紫紅色;
(2)ⅰ.由信息信息一可得:取萃取后的上層清液滴加2-3滴K4[Fe(CN)6]溶液,產生藍色沉淀,
由信息二可得:往探究活動III溶液中加入乙醚,充分振蕩,乙醚層呈血紅色,
| 實 驗 操 作 | 現 象 和 結 論 |
| 步驟一:取萃取后的上層清液滴加2滴K4[Fe(CN)6] | 若產生藍色沉淀,則 猜想一不成立 |
| 步驟二:往探究Ⅲ所得溶液中加入少量乙醚,充分振蕩、靜置分層 | 若乙醚層呈血紅色,則 猜想二成立 |
點評 本題考查了鐵離子和亞鐵離子的檢驗、化學反應的限度等,題目難度中等,注意掌握檢驗鐵離子和亞鐵離子的方法.


 品學雙優卷系列答案
品學雙優卷系列答案 小學期末沖刺100分系列答案
小學期末沖刺100分系列答案 期末復習檢測系列答案
期末復習檢測系列答案 超能學典單元期中期末專題沖刺100分系列答案
超能學典單元期中期末專題沖刺100分系列答案 黃岡360度定制密卷系列答案
黃岡360度定制密卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | Na+、H+、SO42-、OH- | B. | Na+、Cu2+、NO3-、Cl- | ||
| C. | H+、Ca2+、Cl-、NO3- | D. | Ag+ Na+、NO3-、Cl-、 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 mA(g)+nB(g)?pC(g)(正反應為放熱反應)的可逆反應,在恒溫條件下,平衡時B在混合物中的含量(B%)與壓強的關系如圖中實線所示,有關敘述正確的是( )
mA(g)+nB(g)?pC(g)(正反應為放熱反應)的可逆反應,在恒溫條件下,平衡時B在混合物中的含量(B%)與壓強的關系如圖中實線所示,有關敘述正確的是( )| A. | m+n>p | B. | x點的速率關系為v正>v逆 | ||
| C. | n>p | D. | x點比y點混合物反應速率快 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
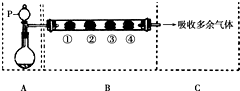 用如圖裝置可以完成一系列實驗(圖中夾持裝置已略去).請回答下列問題:
用如圖裝置可以完成一系列實驗(圖中夾持裝置已略去).請回答下列問題:| B中棉花的位置 | ① | ② | ③ | ④ |
| 所蘸試劑 | 石蕊試液 | 品紅溶液 | 淀粉和碘 水混合液 | 氫硫酸 |
| 現象 | a | b | 褪色 | 淺黃色 |
| 體現SO2的性質 | c | d | e | f |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 一種從植物中提取的天然化合物αdamascone可用于制作“香水”,其結構簡式如圖.有關該化合物的下列說法不正確的是( )
一種從植物中提取的天然化合物αdamascone可用于制作“香水”,其結構簡式如圖.有關該化合物的下列說法不正確的是( )| A. | 分子式為C13H20O | |
| B. | 該化合物可發生加聚反應 | |
| C. | 1 mol該化合物完全燃燒消耗18molO2 | |
| D. | 該物質能使溴水和酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 化學鍵 | H-H | Cl-Cl | H-Cl |
| 鍵能∕(kJ•mol-1) | 436 | 243 | 431 |
| A. | 0.5 H2(g)+0.5 Cl2(g)═HCl(g)△H=-91.5 kJ•mol-1 | |
| B. | H2(g)+Cl2(g)═2HCl(g)△H=-183 kJ•mol-1 | |
| C. | 0.5 H2(g)+0.5 Cl2(g)═HCl(g)△H=+91.5 kJ•mol-1 | |
| D. | 2HCl(g)═H2(g)+Cl2(g)△H=+183 kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com