

分析 (1)高鐵酸根離子具有強氧化性,所以能殺菌消毒,高鐵酸根離子能發生氧化還原反應生成氧氣,同時生成氫氧化鐵,氫氧化鐵具有吸附性;
(2)根據圖象中各粒子的存在情況與溶液pH的關系對各選項進行判斷;
(3)由圖2數據可知,將試樣分別置于不同溫度的恒溫水浴中,來測定c(FeO42-)的變化,顯然是確定溫度對FeO42-濃度的影響情況.
解答 解:(1)高鐵酸根離子具有強氧化性,所以能殺菌消毒,高鐵酸根離子和水反應生成氫氧化鐵膠體,膠體具有吸附性,所以能凈水,反應的離子方程式為:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑,
故答案為:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑;
(2)A.不同PH值時,溶液中鐵元素的存在形態及種數不相同,比如在PH值等于6時,就只有兩種形態,故A錯誤;
B.根據圖片知,向pH=10的這種溶液中加硫酸至pH=2,HFeO4-的分布分數先增大,后減小,故B錯誤;
C.向pH=6的這種溶液中加KOH溶液,發生反應的離子方程式為:HFeO4-+OH-=FeO42-+H2O,故C正確;
故答案為:AB;
(3)由圖2數據可知,溫度越高,相同時間內FeO42-濃度變化越快,且高鐵酸鉀溶液平衡時FeO42-濃度越小,所以該操作的目的是探究溫度變化對FeO42-濃度的影響,
故答案為:探究溫度變化對c(FeO42-)的影響.
點評 本題考查了鹽的水解原理及其應用,題目難度中等,涉及膠體的凈水原理、離子方程式書寫、鹽的水解原理及其影響等知識,試題知識點較多,充分考查了學生靈活應用基礎知識的能力.


 云南師大附小一線名師提優作業系列答案
云南師大附小一線名師提優作業系列答案 沖刺100分單元優化練考卷系列答案
沖刺100分單元優化練考卷系列答案科目:高中化學 來源: 題型:選擇題
 咖啡酸具有止血功效,存在于多種中藥中,其結構簡式如圖:則下列有關說法正確的是( )
咖啡酸具有止血功效,存在于多種中藥中,其結構簡式如圖:則下列有關說法正確的是( )| A. | 該物質中苯環上一氯化物有2種 | |
| B. | 所有碳原子不可能都在同一平面上 | |
| C. | 既能發生取代反應,也能發生加成反應 | |
| D. | 1mol該物質可以與1.5mol碳酸鈉溶液反應生成1.5molCO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫下,pH=1的溶液中還可以大量存在:K+、MnO4-、SO42-、CH3CHO | |
| B. | 含有較多Fe3+的溶液中還可以大量存在:Na+、SO42-、SCN-、CO32- | |
| C. | 碳酸氫鈣溶液與過量的NaOH溶液反應:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| D. | 向FeBr2溶液中通入過量氯氣:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
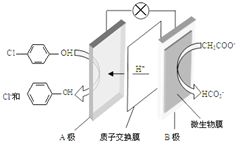 現在污水治理越來越引起人們重視,可以通過膜電池除去廢水中的乙酸鈉和對氯苯酚(
現在污水治理越來越引起人們重視,可以通過膜電池除去廢水中的乙酸鈉和對氯苯酚(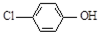 ),其原理如圖所示,下列說法正確的是( )
),其原理如圖所示,下列說法正確的是( )| A. | 當外電路中有0.2mole-轉移時,通過質子交換膜的H+的個數為0.2NA | |
| B. | A極的電極反應式為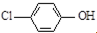 +e-═Cl-+ +e-═Cl-+ | |
| C. | 電流方向從B極沿導線經小燈泡流向A極 | |
| D. | B為電池的正極,發生還原反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,1mol甲基(14C1H3-)所含的中子數和電子數分別為8NA、10NA | |
| B. | 標準狀況下,11.2L五氯化磷中含有P-Cl鍵的數目為2.5NA | |
| C. | 標準狀況下,2.24L Cl2全部被NaOH溶液吸收,轉移的電子數目為0.2NA | |
| D. | 已知反應:2NH3+NO+NO2═2N2+3H2O,每生成2molN2轉移的電子數目為6NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 利用如圖裝置可以制取某些氣體,所用藥品合理且收集氣體方法正確的是( )
利用如圖裝置可以制取某些氣體,所用藥品合理且收集氣體方法正確的是( )| 制取氣體 | 實驗藥品 | 收集氣體方法 | |
| A | 二氧化碳 | 碳酸鈣、稀硫酸 | 排飽和碳酸氫鈉溶液 |
| B | 氧氣 | 雙氧水、二氧化錳 | 排水法 |
| C | 氨氣 | 氧氡化鈉溶液、濃氨水 | 向下排空氣法 |
| D | 乙烯 | 氯乙烷,氫氧化鈉、乙醇 | 排水法 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在沸騰爐和接觸室中,均使用過量的高壓空氣,以提高硫鐵礦的燃燒利用率和二氧化硫的催化氧化轉化率 | |
| B. | 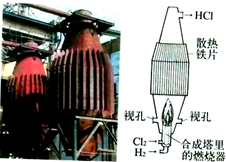 如圖是工業制鹽酸的設備及其簡易圖 | |
| C. | 氯堿工業是中國現代化工之母,其主要反應是電解海水,得到燒堿和氯氣,因此稱為氯堿工業 | |
| D. | 合成氨工業是工業制硝酸和工業制純堿的前提和保證,前者可為后兩者共提供了不止一種原料 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
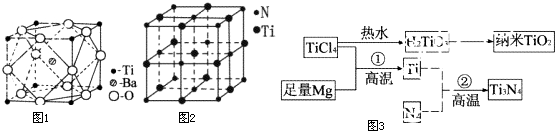
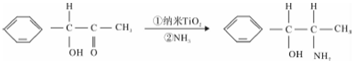
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com