
| 溫度/℃ | 400 | 500 | 830 | 1 000 |
| 平衡常數K | 10 | 9 | 1 | 0.6 |
分析 (1)依據平衡常數隨溫度的變化結合平衡移動原理分析判斷反應的熱量變化,根據表中數據可知,溫度升高平衡常數減小,說明平衡向逆反應方向移動;根據反應方程式及化學平衡常數表達式完成;
(2)根據達到化學平衡狀態,各組分濃度不變,正逆反應相等進行分析;
(3)根據實際生產中,即要考慮反應速率又要考慮轉化率,還要兼顧設備并結合反應特征分析;
(4)依據平衡三段式列式計算反應的一氧化碳,根據轉化率概念計算得到;
(5)為使該反應的反應速率增大,可采用增大壓強、升高溫度、加入催化劑、增大反應物濃度等方法,再結合平衡移動原理分析解答.
解答 解:(1)根據表中數據可知,溫度升高平衡常數減小,說明平衡向逆反應方向移動,則正反應放熱,根據反應CO(g)+H2O(g)?H2(g)+CO2(g)及化學平衡常數表達式,K=$\frac{c({H}_{2})•c(C{O}_{2})}{c(CO)•c({H}_{2}O)}$,
故答案為:放熱;K=$\frac{c({H}_{2})•c(C{O}_{2})}{c(CO)•c({H}_{2}O)}$;
(2)a.反應前后氣體體積不變,壓強始終不會變化,所以壓強不變,無法判斷是否達到平衡狀態,故a錯誤;
b.濃度不變,反應達到了化學平衡狀態,故b正確;
c.正逆反應速率相等,各組分濃度不變,達到了化學平衡狀態,故c正確;
d.濃度相等,不能判斷各組分濃度是否不變,無法判斷是否達到平衡狀態,故d錯誤;
故答案為:bc;
(3)實際生產中,即要考慮反應速率又要考慮轉化率,還要兼顧設備,所以由于反應前后氣體體積不變,又是放熱反應,故溫度不宜太高,所以常壓,400~500℃催化劑最好,
故答案為:C;
(4)830℃時,在2L的密閉容器中加入4molCO(g)和6molH2O(g)達到平衡時,設一氧化碳轉化物質的量為x,
CO(g)+H2O(g)?H2(g)+CO2(g)
起始量(mol) 4 6 0 0
變化量(mol) x x x x
平衡量(mol) 4-x 6-x x x
平衡常數K=$\frac{{x}^{2}}{(4-x)•(6-x)}$=1,解得:x=2.4mol,
所以CO2的平衡濃度為:$\frac{2.4mol}{2L}$=1.2mol/L
用H2濃度變化來表示的平均反應速率=$\frac{\frac{2.4mol}{2L}}{10min}$=0.12mol/(L•min)
CO的轉化率=$\frac{2.4mol/L}{4mol}$×100%=60%,
故答案為:1.2mol/L;0.12mol/(L•min);60%;
(5)a.增大CO的濃度反應速率增大,且該反應向正反應方向移動,故正確;
b.升高溫度,反應速率增大但平衡向逆反應方向移動,故錯誤;
c.分離生成物平衡向右移動,但反應速率減小,故錯誤;
d.選擇高效催化劑能增大反應速率,但平衡不移動,故錯誤;
故答案為:a.
點評 本題考查了化學平衡的計算,題目難度中等,明確影響化學平衡的因素為解答關鍵,注意掌握三段式在化學平衡的計算中的應用,試題培養了學生的分析能力及化學計算能力.


科目:高中化學 來源: 題型:選擇題
| A. | 在元素周期表中,Y所在族的元素都是活潑金屬元素 | |
| B. | 37Z原子核電子數為20 | |
| C. | X與Y能形成YX型化合物 | |
| D. | 在常溫下,Z的單質與氫氣一定能大量共存 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
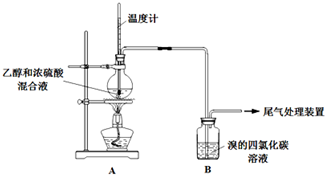
| 操 作 | 現 象 |
| 點燃酒精燈,加熱至170℃ | Ⅰ:A中燒瓶內液體漸漸變黑 Ⅱ:B內氣泡連續冒出,溶液逐漸褪色 |
| … | |
| 實驗完畢,清洗燒瓶 | Ⅲ:A中燒瓶內附著少量黑色顆粒狀物,有刺激性氣味逸出 |

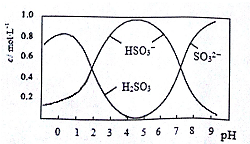
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 一定溫度下,稀釋0.1mol/L的CH3COOH溶液,KW不變,Ka將增大 | |
| B. | 對FeCl3溶液進行稀釋時,Fe3+水解程度將增大,故溶液的酸性將增強 | |
| C. | 可根據Ksp的數值大小直接比較難溶物在水中的溶解度大小 | |
| D. | 25℃時,Ksp(AgCl)>Ksp(AgI),向AgCl懸濁液中加入KI固體,有黃色沉淀生成 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鐵跟硫酸銅溶液反應:2Fe+3Cu2+═2Fe3++3Cu | |
| B. | 碳酸鈣跟醋酸反應CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑ | |
| C. | 在碳酸氫鈣溶液中加入鹽酸CO32-+2H+═CO2↑+H2O | |
| D. | 氫氧化鋇溶液與稀硫酸反應Ba2++OH-+H++SO42-═BaSO4↓+H2O |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com