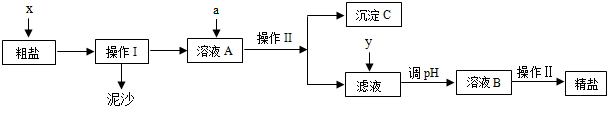
4.某興趣小組同學(xué)在實驗室用自來水配制氫氧化鈉溶液時,發(fā)現(xiàn)溶液中有白色渾濁物.對此現(xiàn)象小組同學(xué)都感到疑惑,于是進(jìn)行了如下探究.
【提出問題】白色渾濁物是什么物質(zhì)?
【查閱資料】①自來水是硬水,常常含有Ca(HCO
3)
2 和Mg(HCO
3)
2.
②Ca(HCO
3)
2 能與氫氧化鈉反應(yīng):Ca(HCO
3)
2+2NaOH=CaCO
3↓+2H
2O+Na
2CO
3Mg(HCO
3)
2能與氫氧化鈉反應(yīng):Mg(HCO
3)
2+2NaOH=Mg(OH)
2↓+2H
2O+Na
2CO
3③Mg(OH)
2在熱水中溶解度增大,可形成稀溶液.
【作出猜想】猜想一:白色渾濁物是CaCO
3猜想二:白色渾濁物是Mg(OH)
2猜想三:白色渾濁物是CaCO
3和Mg(OH)
2.
【實驗探究】

(1)步驟Ⅰ中,發(fā)現(xiàn)杯壁發(fā)燙,原因是 氫氧化鈉溶解放出熱量.
(2)若現(xiàn)象a酚酞溶液不變色,現(xiàn)象b有氣泡冒出,則猜想一正確,有關(guān)反應(yīng)的化學(xué)方程式是CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑.
(3)若現(xiàn)象a液體變紅、現(xiàn)象b有氣泡冒出,則猜想三正確.
【拓展延伸】(1)小紅同學(xué)認(rèn)為濾液B中只含有Na
2CO
3,但小霞同學(xué)認(rèn)為濾液B中還可能存在NaOH.于是,小霞取少量濾液B于試管中,滴加無色酚酞溶液,發(fā)現(xiàn)酚酞溶液變紅,證明濾液B中確實有NaOH.
小薇認(rèn)為由小霞的實驗得出的結(jié)論不正確,理由是碳酸鈉溶液顯堿性,也能使無色酚酞溶液變紅.
為了證明NaOH確實存在,請你寫出對小霞實驗方案的改進(jìn)措施在加入無色酚酞溶液之前,先加入足量的氯化鈣溶液或氯化鋇溶液以除去碳酸鈉的干擾.
(2)寫出從該濾液B中得到純NaOH溶液的化學(xué)方程式Na
2CO
3+Ca(OH)
2═CaCO
3↓+2NaOH.
【實驗反思】
(1)實驗室在配制溶液時,應(yīng)該使用蒸餾水.
(2)判斷自來水是硬水的方法是加肥皂水振蕩,產(chǎn)生泡沫較少.