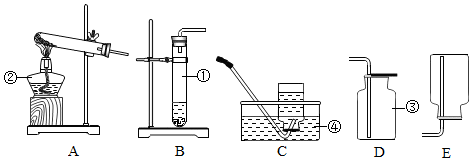
10.請你參與下列實驗探究:
【問題情景】某科學實驗小組同學將鐵粉投入硫酸銅溶液中,發現生成紅色固體物質的同時有較多的氣泡放出.于是,同學們提出問題:生成的是什么氣體?
【提出猜想】從物質組成元素的角度分析,放出的氣體可能是SO
2、O
2、H
2.
【查閱資料】SO
2易溶于水,它能與NaOH反應,生成Na
2SO
3.
【方案設計】依據上述猜想,實驗小組同學分別設計了如下方案:
(1)甲同學認為是O
2,收集一瓶該氣體,檢驗方法是用帶火星的木條試驗,看木條是否復燃.
(2)乙同學認為是SO
2,則只需將放出的氣體通入盛有NaOH溶液的洗氣瓶中,稱量通氣前后洗氣瓶的質量.寫出SO
2與NaOH反應的化學方程式SO
2+2NaOH=Na
2SO
3+H
2O.
(3)實驗小組同學合作設計了如下組合實驗方案,排除和驗證猜想的氣體.如果放出的是O
2和H
2,你認為方案中的安全隱患是實驗時在B裝置中易發生爆炸事故.
【實驗探究】經丙同學檢驗確認安全后,小組同學首先對裝置A進行稱量,再將收集到的氣體從a通入,過一會兒點燃B處酒精燈;一段時間后,發現表面含CuO的銅網由黑色變為光亮的紅色;停止通氣,再次稱量裝置A,發現質量無增減.
結論:鐵粉與硫酸銅溶液反應時,產生的氣體是H
2.
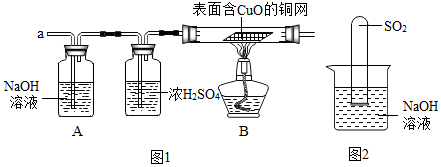
【思維拓展】
①由上述實驗可以推出,硫酸銅溶液中可能含有酸性(選填:“酸性”、“堿性”或“中性”)物質.
②不通過稱量,如何判斷SO
2與NaOH溶液發生了反應呢?有一同學設計了圖2所示的裝置進行實驗,發現試管內液面上升,就得出SO
2與NaOH溶液發生反應的結論.其他同學認為這一方案不嚴謹,理由是SO
2易溶于水,也能使液面上升.要得到科學嚴謹的結論,仍利用該裝置,補做的實驗是將NaOH溶液換成水做對比實驗.

 實驗室中,操作不規范有極大的安全隱患.回答下列問題:
實驗室中,操作不規范有極大的安全隱患.回答下列問題: