
科目: 來源: 題型:實驗探究題

| B | C | D | E | F | |
| 反應前 | 122.0g | 250.0g | 300.0g | 350.0g | 330.0g |
| 反應后 | 120.6g | 250.2g | 301.0g | 350.1g | 332.0g |
查看答案和解析>>
科目: 來源: 題型:實驗探究題
| 方案編號 | 方案1 | 方案2 |
| 實驗操作 (分別取少量實驗后的溶液于試管中) | 加入少許氧化鐵 | 滴加硝酸銀溶液 |
| 實驗現象 | 固體逐漸消失,溶液由無色變成黃色 | 產生白色沉淀. |
| 實驗結論 | 猜想二成立. | |
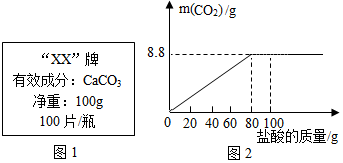
| 第1次 | 第3次 | 第4次 | |
| 加入鹽酸的質量(g) | 20 | 20 | 20 |
| 剩余固體的質量(g) | 35 | a | 20 |
查看答案和解析>>
科目: 來源: 題型:實驗探究題
 研究性學習小組選擇“H2O2 生成O2 的快慢與什么因素有關”的課題進行探究,以下是他們探究的主要過程:
研究性學習小組選擇“H2O2 生成O2 的快慢與什么因素有關”的課題進行探究,以下是他們探究的主要過程:| 實驗編號 | 1 | 2 |
| 反應物 | 5%H2O2 | 5%H2O2 |
| 催化劑 | 1g水泥塊 | 1gMnO2 |
| 時間 | 165秒 | 46秒 |
查看答案和解析>>
科目: 來源: 題型:實驗探究題
| 實驗 編號 | 溫度 | 鹽酸 濃度 | 鋁片消失的時間/s |
| ① | 20℃ | 5% | 60 |
| ② | 20℃ | 10% | 42 |
| ③ | 40℃ | 10% | 30 |
查看答案和解析>>
科目: 來源: 題型:實驗探究題
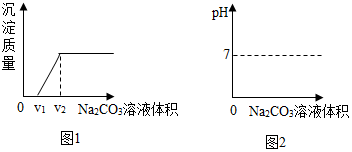
查看答案和解析>>
科目: 來源: 題型:實驗探究題
 研究性學習小組選擇“H2O2 生成O2 的快慢與什么因素有關”的課題進行探究,以下是他們探究的主要過程:
研究性學習小組選擇“H2O2 生成O2 的快慢與什么因素有關”的課題進行探究,以下是他們探究的主要過程:| 實驗編號 | 1 | 2 |
| 反應物 | 5%H2O2 | 5%H2O2 |
| 催化劑 | 1g水泥塊 | 1gMnO2 |
| 時間 | 165秒 | 46秒 |
查看答案和解析>>
科目: 來源: 題型:解答題
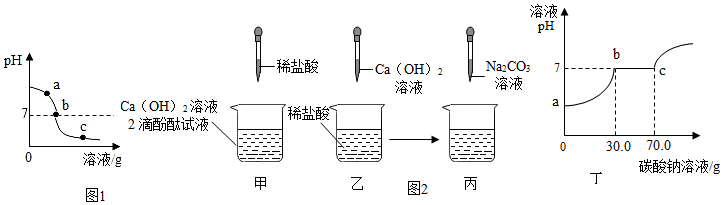
| 實驗步驟 | 實驗現象 | 實驗結論 |
| 另取少量余下樣品于兩支試管中,分別滴加足量的Na CO,溶液 | 只產生白色沉淀 | 該樣品為b處溶液 |
| 先產生氣泡,后產生白色沉淀 | 該樣品為c處溶液,并推知液中的陽離子有Ca2+、H+ |
查看答案和解析>>
科目: 來源: 題型:實驗探究題
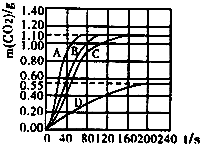 化學實驗小組在用鹽酸和大理石制取二氧化碳時,發現產生氣泡的速率不一樣,同學們展開了探究.所用鹽酸濃度為10%、20%,大理石有細顆粒與粗顆粒兩種規格,實驗溫度為20℃、30℃,每次實驗鹽酸的用量為100mL、大理石用量為10.0g.
化學實驗小組在用鹽酸和大理石制取二氧化碳時,發現產生氣泡的速率不一樣,同學們展開了探究.所用鹽酸濃度為10%、20%,大理石有細顆粒與粗顆粒兩種規格,實驗溫度為20℃、30℃,每次實驗鹽酸的用量為100mL、大理石用量為10.0g.| 實驗 編號 | 溫度(℃) | 大理石 規格 | 鹽酸濃度(均取100mL) | 實驗目的 |
| ① | 20 | 粗顆粒 | 20% | (Ⅰ)實驗①和②探究鹽酸濃度對該反應速率的影響; (Ⅱ)實驗①和探究溫度對該反應速率的影響; (Ⅲ)實驗①和探究大理石規格(粗、細)對該反應速率的影響; |
| ② | 20 | 粗顆粒 | 10% | |
| ③ | 細顆粒 | 20% | ||
| ④ | | 粗顆粒 | 20% |
查看答案和解析>>
科目: 來源: 題型:填空題
 化學興趣小組的同學們用下列藥品探究影響金屬與酸反應速率的因素.裝置中產生氫氣的量可以用壓強傳感器測出(在等溫條件下,產生氫氣體積與裝置內壓強成正比.反應放熱忽略不計)
化學興趣小組的同學們用下列藥品探究影響金屬與酸反應速率的因素.裝置中產生氫氣的量可以用壓強傳感器測出(在等溫條件下,產生氫氣體積與裝置內壓強成正比.反應放熱忽略不計)查看答案和解析>>
科目: 來源: 題型:實驗探究題
| 實驗編號 | 硫酸的質量分數(均取20mL) | 鋅的形狀(均取1g) | 氫氣的體積(mL)(均收集3分鐘) |
| ① | 20% | 鋅粒 | 31.7 |
| ② | 20% | 鋅片 | 50.9 |
| ③ | 30% | 鋅粒 | 61.7 |
| ④ | 30% | 鋅片 | 79.9 |
 根據進入量筒中水的體積,判斷生成氫氣的體積,氫氣應從e(填e或f或g)管通入.
根據進入量筒中水的體積,判斷生成氫氣的體積,氫氣應從e(填e或f或g)管通入.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com