
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:解答題
查看答案和解析>>
科目: 來源: 題型:解答題
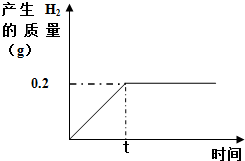 取一定質量的鐵粉與100g稀硫酸反應,鐵粉與稀硫酸恰好完全反應.產生的氫氣隨時間的變化如圖所示:
取一定質量的鐵粉與100g稀硫酸反應,鐵粉與稀硫酸恰好完全反應.產生的氫氣隨時間的變化如圖所示:查看答案和解析>>
科目: 來源: 題型:實驗探究題
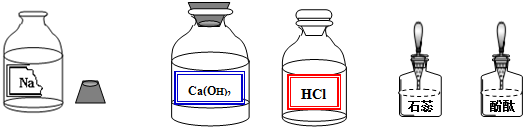
查看答案和解析>>
科目: 來源: 題型:實驗探究題
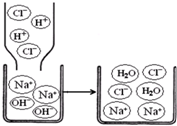
查看答案和解析>>
科目: 來源: 題型:填空題
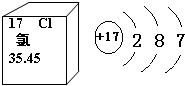 氯在周期表中的信息和原子結構示意圖如圖.
氯在周期表中的信息和原子結構示意圖如圖.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com