
分析 鋅與硫酸反應生成硫酸鋅和氫氣;根據質量守恒定律,利用鋅的質量,根據反應的化學方程式列式計算出生成氫氣的質量、以及硫酸的質量和生成硫酸鋅的質量,進而求出稀硫酸的溶質質量分數以及生成物溶液的溶質質量分數進行解答.
解答 解:(1)生成氫氣的質量:(100 g+20 g+5 g+0.8 g+10 g)-135.6 g=0.2 g
(2)設參加反應的鋅的質量為x,硫酸質量為y,反應生成硫酸鋅質量為z
Zn+H2SO4═ZnSO4+H2
65 98 161 2
x y z 0.2 g
$\frac{65}{x}=\frac{98}{y}=\frac{161}{z}=\frac{2}{0.2g}$
x=$\frac{65×0.2g}{2}$=6.5 g
y=$\frac{98×0.2g}{2}$=9.8 g
z=$\frac{161×0.2g}{2}$=16.1 g
稀硫酸中硫酸的質量分數是:$\frac{9.8g}{50g}$×100%=19.6%
反應后溶液中溶質質量分數是:$\frac{161.1g}{50g+6.5g-0.2g}$×100%=28.6%
答案:(1)生成氫氣的質量為0.2 g; (2)稀硫酸中硫酸的質量分數是19.6%; (3)反應后溶液中溶質質量分數是28.6%.
點評 本題難度不大,掌握根據化學方程式的計算即可正確解答本題.


科目:初中化學 來源: 題型:選擇題
| A. | 尋找金屬替代品有利于保護金屬資源 | |
| B. | 植樹造林有利于保護空氣資源 | |
| C. | 禁止廢水任意排放有利于保護水資源 | |
| D. | 用乙醇汽油代替汽油能抑制溫室效應 |
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
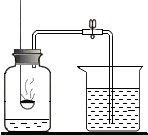 用燃燒紅磷(紅磷過量)的方法測定空氣中氧氣的含量,如圖所示,當火焰熄滅后,打開彈簧夾,燒杯中的水流入集氣瓶中,約占總體積的$\frac{1}{5}$,剩余氣體主要是氮氣.根據觀察的現象推測,氮氣具有哪些性質?
用燃燒紅磷(紅磷過量)的方法測定空氣中氧氣的含量,如圖所示,當火焰熄滅后,打開彈簧夾,燒杯中的水流入集氣瓶中,約占總體積的$\frac{1}{5}$,剩余氣體主要是氮氣.根據觀察的現象推測,氮氣具有哪些性質?查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com