
分析 (1)根據氧化銅和硫酸反應生成硫酸銅和水,硫酸銅和鐵會生成硫酸亞鐵和銅,鐵和硫酸反應生成硫酸亞鐵和氫氣,然后依據反應前后固體質量不變進行分析;
(2)最后生成的溶質是FeSO4,它是由兩部分生成的.第一部分與CuSO4反應得到的FeSO4,第二部分是鐵與剩余硫酸生成的FeSO4,反應后溶液中總共含有FeSO4為兩部分的質量和;利用鐵和硫酸銅反應以及氧化銅的關系求出氧化銅的質量即可.
(3)根據質量守恒定律,反應后所得溶液總質量=100g稀硫酸+氧化銅的質量+鐵的質量-析出的銅的質量(與鐵的質量相等)-氫氣質量,由于參加反應鐵的質量與析出固體的質量相等,所以反應后所得溶液的總質量=100g稀硫酸+氧化銅的質量-氫氣質量.則最后得到溶液的質量分數為生成FeSO4的總質量與反應后所得溶液總質量的比.
解答 解:(1)氧化銅和硫酸反應生成硫酸銅和水,硫酸銅和鐵會生成硫酸亞鐵和銅,鐵和硫酸反應生成硫酸亞鐵和氫氣,所以最后的固體物質中有鐵粉的質量為0.
(2)設與硫酸反應的鐵的質量為x,與硫酸銅反應的鐵的質量為y,固體增加質量為m
Fe+H2SO4═FeSO4+H2↑ 固體減少
56 56
x x
Fe+CuSO4═FeSO4+Cu 固體質量增加
56 64 8
y m
$\frac{56}{y}=\frac{8}{m}$
m=$\frac{y}{7}$
所以x+y=16.8①
化學反應前后固體質量不變,所以 x=$\frac{y}{7}$
由①②可知,x=2.1g,y=16.8g-2.1g=14.7g
設氧化銅質量為z,
Fe--CuSO4---CuO
56 80
14.7g z
$\frac{56}{14.7g}=\frac{80}{z}$
z=21g
(2)鐵和硫酸反應生成硫酸亞鐵質量為w,生成氫氣為a
Fe+H2SO4═FeSO4+H2↑
56 152 2
2.1g w a
$\frac{56}{2.1g}=\frac{152}{w}=\frac{2}{a}$
w=5.7g
a=0.075g
鐵和硫酸銅反應生成硫酸亞鐵質量為h
Fe+CuSO4═FeSO4+Cu 固體質量增加
56 152
14.7g h
$\frac{56}{14.7g}=\frac{152}{h}$
h=39.9g
$\frac{5.7g+39.9g}{100g+21g-0.075g}$×100%=37.7%.
最后的固體物質中有16.8g-
答:(1)最后的固體物質中鐵粉質量為0.
(2)原加入的氧化銅質量是21g;
(3)最后得到的溶液的質量分數是37.7%.
點評 分析固體質量不變的原因是解決本題的關鍵:要使加入的鐵粉和得到的固體質量相等必須使硫酸消耗多余的Fe,且消耗鐵粉的質量與置換出銅固體增加的質量相等.


科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
| 實驗內容 | 實驗現象 |
| 將維生素C藥片研碎,加入蒸餾水配成溶液,取溶液少許注入試管,然后滴入幾滴試液,觀察現象. | 溶液變成紅色,說明維生素C具有酸性. |
| 將維生素C藥片研碎,加入蒸餾水配成溶液,再取少許氫氧化鈉溶液注入試管并滴入幾滴無色酚酞試液,然后逐滴加入維生素C溶液,觀察現象. | 如氫氧化鈉溶液顏色,說明說明維生素C具有酸性 |
| 汁液 | 新鮮西紅柿的汁液 | 放置一周的西紅柿的汁液 |
| 滴數 | 12 | 20 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
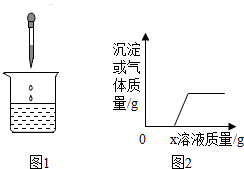 向燒杯中逐滴加入x溶液至過量(圖1),生成沉淀或氣體的質量與加入溶液的質量關系符合圖2的是( )
向燒杯中逐滴加入x溶液至過量(圖1),生成沉淀或氣體的質量與加入溶液的質量關系符合圖2的是( )| 燒杯中的物質 | x溶液 | |
| A | 氯化鈉和碳酸氫鈉溶液 | 稀鹽酸 |
| B | 需硫酸和稀鹽酸 | 氯化鋇溶液 |
| C | 黃銅粉末 | 稀鹽酸 |
| D | 稀鹽酸和硫酸鎂溶液 | 燒堿溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題

| A. | 該粉末可能是CaCO3 | B. | 該粉末一定是堿 | ||
| C. | 該粉末可能是Na2CO3 | D. | 該粉末中一定含有CO32- |
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
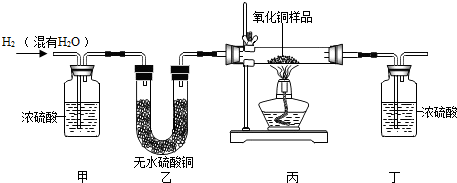
| 裝置丙 | 裝置丁 | |
| 反應前 | 48.8克 | 161.2克 |
| 反應后 | 46.5克 | 163.9克 |
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| 物質 | 甲 | 乙 | 丙 | 丁 |
| 反應前的質量/g | 2 | 30 | 20 | 10 |
| 反應后的質量/g | m | 39 | 5 | 16 |
| A. | 該反應是化合反應 | |
| B. | 甲是該反應的催化劑 | |
| C. | 反應過程中乙、丙變化的質量比為3:5 | |
| D. | 丙可能是單質 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com