
| 試驗次數 | 1 | 2 | 3 | 4 | 5 |
| 加入稀硫酸的質量/g | 20 | 20 | 20 | 20 | 20 |
| 充分反應后剩余固體的質量/g | 8 | 6 | 4 | 3 | m |
| 所得溶液的硫酸銅質量分數/% | P1 | P2 | P3 | P4 | P5 |
分析 (1)根據實驗數據分析出加入的稀硫酸與參加反應的氧化銅的質量比關系,進而可確定m的值;固體前后減少的質量為氧化銅的質量;
(2)根據實驗數據可知20克稀硫酸與2克氧化銅恰好完全反應,利用氧化銅與硫酸反應的化學方程式,根據2克氧化銅的質量求出20克稀硫酸中溶質的質量,進一步求出稀硫酸中溶質的質量分數;
(3)根據所得溶液中溶質的質量分數公式判斷.
解答 解:(1)根據實驗數據分析可知,第一次加入20克稀硫酸,有(10-8)gCuO被消耗掉,因此每20克稀硫酸與2克氧化銅恰好完全反應,第四次加入20克稀硫酸后只減小了1克氧化銅,說明氧化銅已反應完,第五次再加入稀硫酸,剩余固體的質量也不會減少.所以m的值為3.
氧化銅的質量=10g-3g=7g;
(2)設20克稀硫酸中溶質的質量為x
CuO+H2SO4═CuSO4+H2O
80 98
2g x
$\frac{80}{2g}$=$\frac{98}{x}$
x=2.45g
H2SO4溶液中溶質質量分數=$\frac{2.45g}{20g}$×100%=12.25%;
(3)根據實驗數據分析可知,第一次加入20克稀硫酸,有(10-8)gCuO被消耗掉,因此每20克稀硫酸與2克氧化銅恰好完全反應,第四次加入20克稀硫酸后只減小了1克氧化銅,說明前三次每20克稀硫酸與2克氧化銅恰好完全反應,溶質增加和溶液增加成正比,所得溶液的硫酸銅質量分數相等,4、5次溶質增加小于溶液增加比例;所以所得溶液的硫酸銅質量分數P1=P2=P3>P4
故答案為:(1)3; 7.(2)12.25%;
(3)P1=P2=P3>P4
點評 解答本題可用數據分析法,即解題時正確分析數據,找出數據的變化特征及彼此之間的關系,將綜合復雜的問題分解為簡單的計算,從而順利解題.


 星級口算天天練系列答案
星級口算天天練系列答案 芒果教輔達標測試卷系列答案
芒果教輔達標測試卷系列答案科目:初中化學 來源: 題型:填空題
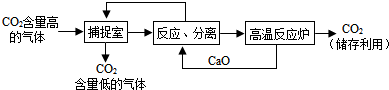
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 甲同學推測氣體可能是H2,并收集氣體用點燃法檢驗 | |
| B. | 乙同學繼續用鎂條與該FeCl3溶液反應,觀察產生氣泡的快慢 | |
| C. | 丙同學用鋅粒與該FeCl3溶液反應,觀察是否有氣泡產生 | |
| D. | 丁同學猜想該FeCl3溶液呈酸性,并用pH試紙檢測 |
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
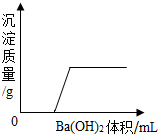 某溶液由NaOH、HCl、H2SO4和MgCl2中的一種或幾種組成,向該溶液中滴加Ba(OH)2溶液,產生沉淀的質量與加入Ba(OH)2溶液質量的關系如圖,下列說法正確的是( )
某溶液由NaOH、HCl、H2SO4和MgCl2中的一種或幾種組成,向該溶液中滴加Ba(OH)2溶液,產生沉淀的質量與加入Ba(OH)2溶液質量的關系如圖,下列說法正確的是( )| A. | HCl和MgCl2一定存在 | |
| B. | NaOH、H2SO4和MgCl2一定不存在 | |
| C. | HCl和H2SO4一定存在 | |
| D. | HCl一定存在,NaOH、H2SO4一定不存在,MgCl2可能存在 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
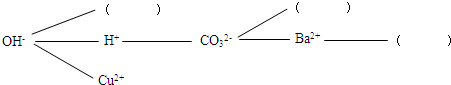
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com