
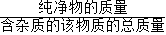 ×100%和溶液中溶質的質量分數=
×100%和溶液中溶質的質量分數= ×100%.
×100%.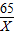 =
=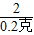 X=6.5克
X=6.5克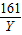 =
=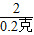 Y=16.1克
Y=16.1克 ×100%=
×100%= ×100%=65%
×100%=65% ×100%=
×100%= ×100%≈15.1%
×100%≈15.1%

 精英口算卡系列答案
精英口算卡系列答案 應用題點撥系列答案
應用題點撥系列答案 狀元及第系列答案
狀元及第系列答案 同步奧數系列答案
同步奧數系列答案科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源: 題型:
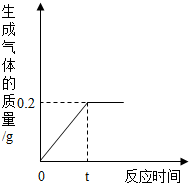 (2012?奉賢區模擬)為測定某粗鋅樣品中鋅的質量分數,取10g粗鋅樣品(含少量雜質,且雜質不溶于水,也不與酸反應)于燒杯中,向其中加入足量的稀硫酸,生成氣體的質量與反應時間的關系如圖所示,試回答下列問題:
(2012?奉賢區模擬)為測定某粗鋅樣品中鋅的質量分數,取10g粗鋅樣品(含少量雜質,且雜質不溶于水,也不與酸反應)于燒杯中,向其中加入足量的稀硫酸,生成氣體的質量與反應時間的關系如圖所示,試回答下列問題:查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源:不詳 題型:問答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com