

分析 (1)硫酸亞鐵和氫氧化鈉反應生成氫氧化亞鐵沉淀和硫酸鈉;
(2)硫酸與氧化鐵的反應生成硫酸鐵和水;
(3)少量氧化鐵和硫酸反應生成硫酸鐵和水,鐵和硫酸鐵反應生成硫酸亞鐵;
(4)化合物中元素化合價代數和為零;
化學反應前后,元素的種類不變,原子的種類、總個數不變;
(5)根據反應的化學方程式和提供的數據可以進行相關方面的計算.
解答 解:(1)硫酸亞鐵和氫氧化鈉反應生成氫氧化亞鐵沉淀和硫酸鈉,因此試劑X是NaOH.
故填:NaOH.
(2)硫酸與氧化鐵的反應的化學方程式為:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O.
故填:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O.
(3)往鐵粉(含少量氧化鐵)中加入硫酸,除鐵、氧化鐵與硫酸發生反應外,一定還發生其它反應.作出這種判斷的依據是鐵能和氧化鐵與硫酸反應生成的硫酸鐵反應.
故填:鐵能和氧化鐵與硫酸反應生成的硫酸鐵反應.
(4)設氫氧化亞鐵中鐵元素的化合價為x,
氫氧化亞鐵中,氫元素的化合價是+1,氧元素化合價是-2,根據題意有:x+(-2)×2+(+1)×2=0,
x=+2;
由質量守恒定律可知,通入氧氣時的化學方程式為:4Fe(OH)2+2H2O+O2═4Fe(OH)3;
由沉淀獲得Fe3O4的過程中發生的反應為Fe(OH)2+2Fe(OH)3$\frac{\underline{\;加熱\;}}{\;}$Fe3O4+4H2O,因此,通入氧氣時,必須控制“一定量”,其目的是防止氫氧化亞鐵被完全氧化成氫氧化鐵.
故填:+2;H2O;防止氫氧化亞鐵被完全氧化成氫氧化鐵.
(5)設硫酸亞鐵質量為y,
FeSO4+2NaOH=Na2SO4+Fe(OH)2↓,
152 90
y 13.5g
$\frac{152}{y}$=$\frac{90}{13.5g}$,
y=22.8g,
FeSO4溶液中溶質的質量分數是:$\frac{22.8g}{100g}$×100%=22.8%,
設最終得到產品四氧化三鐵質量為z,
由反應過程可知,硫酸亞鐵中的鐵元素完全轉化到四氧化三鐵中,
根據題意有:22.8g×$\frac{56}{152}$×100%=z×$\frac{168}{232}$×100%,
z=11.6g,
答:FeSO4溶液中溶質的質量分數是22.8%,最終得到產品四氧化三鐵質量是11.6g.
點評 本題主要考查物質的性質,解答時要根據各種物質的性質,結合各方面條件進行分析、判斷,從而得出正確的結論.


 智慧課堂密卷100分單元過關檢測系列答案
智慧課堂密卷100分單元過關檢測系列答案 單元期中期末卷系列答案
單元期中期末卷系列答案科目:初中化學 來源: 題型:選擇題
| A. | ①②⑤⑥ | B. | ③④⑥ | C. | ①②③ | D. | ③④ |
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
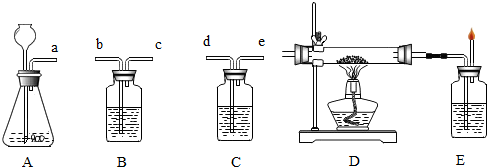
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題

| A. | 碳的相對原子質量為12.01 | B. | 氮原子的核外電子數為7 | ||
| C. | 氧元素只能形成一種單質 | D. | C、N、O的原子序數依次增加 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | +2 | B. | +4 | C. | +6 | D. | -2 |
查看答案和解析>>
科目:初中化學 來源: 題型:推斷題
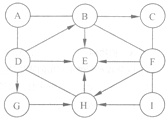 如圖中的A-I表示幾種初中化學常見的純凈物,且分別是由H、C、O、S、Cl、Na、Ca中的兩種或兩種以上元素組成.其中A、E、H是氧化物;A中氧元素質量分數為50%;I俗稱小蘇打,C、I分別與足量F反應的生成物相同.圖中“--”表示兩端的物質問能發生化學反應;“一”表示物質間存在轉化關系:部分反應物或生成物已略去.
如圖中的A-I表示幾種初中化學常見的純凈物,且分別是由H、C、O、S、Cl、Na、Ca中的兩種或兩種以上元素組成.其中A、E、H是氧化物;A中氧元素質量分數為50%;I俗稱小蘇打,C、I分別與足量F反應的生成物相同.圖中“--”表示兩端的物質問能發生化學反應;“一”表示物質間存在轉化關系:部分反應物或生成物已略去.查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com