
| 序號 | 化學反應 |
| ① | Fe3O4+CO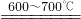 FeO+CO2 FeO+CO2 |
| ② | 3Fe2O3+CO 2Fe3O4+CO2 2Fe3O4+CO2 |
| ③ | FeO+CO Fe+CO2 Fe+CO2 |
| 實驗內(nèi)容 | 實驗現(xiàn)象 | |
| 實驗一 | 冷卻后,稱量剩余固體 | 剩余固體質(zhì)量為1.76g |
| 實驗二 | 取一部分剩余固體,用磁鐵靠近 | 部分粉末能被磁鐵吸引 |
 ;若以原固體中氧元素的轉(zhuǎn)化來表達反應的轉(zhuǎn)化率則該反應轉(zhuǎn)化率為________.(結果用百分數(shù)表示,保留一位小數(shù)).
;若以原固體中氧元素的轉(zhuǎn)化來表達反應的轉(zhuǎn)化率則該反應轉(zhuǎn)化率為________.(結果用百分數(shù)表示,保留一位小數(shù)).  ×100%=0.72g,反應的轉(zhuǎn)化率是:
×100%=0.72g,反應的轉(zhuǎn)化率是: =88.9%
=88.9%

科目:初中化學 來源: 題型:
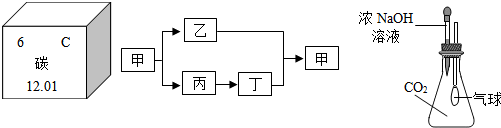
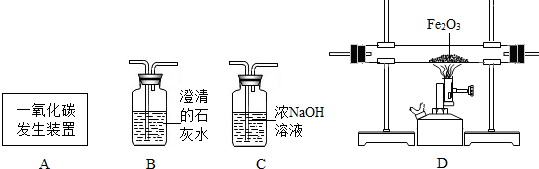
查看答案和解析>>
科目:初中化學 來源: 題型:
| 序號 | 化學反應 | ||||
| ① | Fe3O4+CO
| ||||
| ② | 3Fe2O3+CO
| ||||
| ③ | FeO+CO
|
| 實驗內(nèi)容 | 實驗現(xiàn)象 | |
| 實驗一 | 冷卻后,稱量剩余固體 | 剩余固體質(zhì)量為1.76g |
| 實驗二 | 取一部分剩余固體,用磁鐵靠近 | 部分粉末能被磁鐵吸引 |
| 化合物中已反應A元素質(zhì)量 |
| 化合物中A元素總質(zhì)量 |
查看答案和解析>>
科目:初中化學 來源:不詳 題型:問答題
| 序號 | 化學反應 | ||||
| ① | Fe3O4+CO
| ||||
| ② | 3Fe2O3+CO
| ||||
| ③ | FeO+CO
|
| 實驗內(nèi)容 | 實驗現(xiàn)象 | |
| 實驗一 | 冷卻后,稱量剩余固體 | 剩余固體質(zhì)量為1.76g |
| 實驗二 | 取一部分剩余固體,用磁鐵靠近 | 部分粉末能被磁鐵吸引 |
| 化合物中已反應A元素質(zhì)量 |
| 化合物中A元素總質(zhì)量 |
查看答案和解析>>
科目:初中化學 來源:2012-2013學年江蘇省常州市九年級(上)期末化學試卷(解析版) 題型:填空題
| 序號 | 化學反應 |
| ① | Fe3O4+CO FeO+CO2 FeO+CO2 |
| ② | 3Fe2O3+CO 2Fe3O4+CO2 2Fe3O4+CO2 |
| ③ | FeO+CO Fe+CO2 Fe+CO2 |
| 實驗內(nèi)容 | 實驗現(xiàn)象 | |
| 實驗一 | 冷卻后,稱量剩余固體 | 剩余固體質(zhì)量為1.76g |
| 實驗二 | 取一部分剩余固體,用磁鐵靠近 | 部分粉末能被磁鐵吸引 |
 ;若以原固體中氧元素的轉(zhuǎn)化來表達反應的轉(zhuǎn)化率則該反應轉(zhuǎn)化率為 .(結果用百分數(shù)表示,保留一位小數(shù)).
;若以原固體中氧元素的轉(zhuǎn)化來表達反應的轉(zhuǎn)化率則該反應轉(zhuǎn)化率為 .(結果用百分數(shù)表示,保留一位小數(shù)).查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com