
分析 根據原物質和雜質的性質選擇適當的除雜劑和分離方法,所謂除雜(提純),是指除去雜質,同時被提純物質不得改變.除雜質題至少要滿足兩個條件:①加入的試劑只能與雜質反應,不能與原物質反應;②反應后不能引入新的雜質.
解答 解:(1)碳酸鈣高溫分解生成氧化鈣和二氧化碳,能除去雜質且沒有引入新的雜質,符合除雜原則,反應的化學方程式為:CaCO3$\frac{\underline{\;高溫\;}}{\;}$CaO+CO2↑.
(2)氧化鐵與足量的稀鹽酸反應生成氯化鐵和水,然后過濾即可,能除去雜質且沒有引入新的雜質,符合除雜原則,反應的化學方程式為:Fe2O3+6HCl═2FeCl3+3H2O.
(3)CuO能與稀硫酸反應生成硫酸銅和水,銅不與稀硫酸反應,然后過濾即可,能除去雜質且沒有引入新的雜質,符合除雜原則,反應的化學方程式為:H2SO4+CuO═CuSO4+H2O.
(4)氧化鈣與水反應生成氫氧化鈣,能除去雜質且沒有引入新的雜質,符合除雜原則,反應的化學方程式為:CaO+H2O═Ca(OH)2.
(5)氧化鈣與稀鹽酸反應生成氯化鈣和水,碳不與稀鹽酸反應,然后過濾即可,能除去雜質且沒有引入新的雜質,符合除雜原則,反應的化學方程式為:CaO+2HCl=CaCl2+H2O.
(6)鐵與稀硫酸反應生成硫酸亞鐵溶液和氫氣,能除去雜質且沒有引入新的雜質,符合除雜原則,反應的化學方程式為:Fe+H2SO4═FeSO4+H2↑.
(7)要除去NaOH溶液中的Na2CO3,實質就是除去碳酸根離子,可利用碳酸鈉溶液與氫氧化鈣反應生成碳酸鈣沉淀和氫氧化鈉溶液,然后過濾即可,能除去雜質且沒有引入新的雜質,符合除雜原則,反應的化學方程式為:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
故答案為:(1)CaCO3$\frac{\underline{\;高溫\;}}{\;}$CaO+CO2↑;(2)Fe2O3+6HCl═2FeCl3+3H2O;(3)H2SO4+CuO═CuSO4+H2O;(4)CaO+H2O═Ca(OH)2;(5)CaO+2HCl=CaCl2+H2O;(6)Fe+H2SO4═FeSO4+H2↑;(7)Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
點評 物質的分離與除雜是中考的重點,也是難點,解決除雜問題時,抓住除雜質的必需條件(加入的試劑只與雜質反應,反應后不能引入新的雜質)是正確解題的關鍵.


科目:初中化學 來源: 題型:選擇題
| A. | 用石蕊試液鑒別H2O2和H2O | B. | 用澄清石灰水鑒別CO2和CO | ||
| C. | 用聞氣味法鑒別酒精和白醋 | D. | 用點燃法鑒別棉纖維和羊毛 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 該反應中涉及的物質都是氧化物 | |
| B. | 高鐵酸鈉中鐵元素質量分數最大 | |
| C. | 化學計量數m=n | |
| D. | 該反應中,鐵元素的化合價由+3價升高到+6價 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 托盤天平、燒杯、玻璃棒 | B. | 量筒、托盤天平、燒杯 | ||
| C. | 量筒、燒杯、玻璃棒 | D. | 量筒、玻璃棒 |
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
| 1 | 溶質 | 溶劑 |
| 氫氧化鈉溶液 | 氫氧化鈉 | 水 |
| 碘酒 | 碘 | 酒精 |
| 鹽酸 | 氯化氫 | 水 |
| 石灰水 | 氫氧化鈣 | 水 |
| 硫酸銅溶液 | 硫酸銅 | 水 |
| 白磷的二硫化碳溶液 | 白磷 | 二硫化碳 |
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
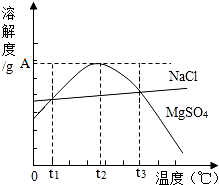 如圖是NaCl、MgSO4的溶解度曲線.下列說法正確的是( )
如圖是NaCl、MgSO4的溶解度曲線.下列說法正確的是( )| A. | 只有在t1℃時,NaCl和MgSO4的溶解度才相等 | |
| B. | t1℃~t2℃,MgSO4的溶解度隨溫度升高而增大 | |
| C. | 在t2℃時,MgSO4溶液的溶質質量分數最大 | |
| D. | 把MgSO4飽和溶液的溫度從t3℃降至t2℃時,變成不飽和溶液 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 水、硝酸銀、稀硝酸 | B. | 水、氫氧化鈉、稀鹽酸 | ||
| C. | 水、氫氧化鉀、稀硝酸 | D. | 水、氫氧化鉀、稀鹽酸 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com