一定質量的A溶液和111g氯化鈣溶液恰好完全反應,生成白色沉淀B.化學方程式為:A+CaCl2═B↓+2NaCl.
(1)A的化學式為______.
(2)濾出沉淀B,再烘干,稱量得10g,則CaCl2溶液中溶質的質量分數為多少?
【答案】
分析:題綜合性比較強,第一問可根據質量守恒定律和復分解反應的特征來解答.在(2)中要求先會寫出:A+CaCl
2═B↓+2NaCl的真正的化學方程式即 Na
2CO
3+CaCl
2=CaCO
3↓+2NaCl然后根據題中的信息求出CaCl
2溶液的溶質質量.進而便可求出氯化鈣溶液的溶質質量分數.
解答:解:(1)根據復分解反應的特征A物質必定含有的金屬元素是鈉,B是一種含鈣的沉淀,常見的鈣的沉淀是碳酸鈣,所以A是碳酸鈉,帶入方程式該方程式為Na
2CO
3+CaCl
2=CaCO
3↓+2NaCl,與A+CaCl
2═B↓+2NaCl的特征正好符合;
(2)設111g氯化鈣溶液中含有的氯化鈣質量是x
Na
2CO
3+CaCl
2=CaCO
3↓+2NaCl
111 100
x 10g

x=11.1g
則CaCl
2溶液中溶質的質量分數為
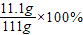
=10%
故答案為:(1)CaCO
3 (2)答:CaCl
2溶液中溶質的質量分數為10%.
點評:本題是一道綜合性比較強的試題,要求學生要掌握復分解反應的特征、以及能根據化學方程式進行計算、并利用所給的質量會求溶液中溶質質量分數.


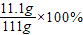 =10%
=10%
