(1)在氧氣和二氧化硫的混合氣體中,其中氧元素的質量分數為60%,則該混合氣體中氧氣和二氧化硫的質量比為________混合氣體中二氧化硫的質量分數為________.
(2)一定質量的A溶液和111g氯化鈣溶液恰好完全反應,生成白色沉淀B.化學方程式為:A+CaCl2═B↓+2NaCl.
①A的化學式為________.
②濾出沉淀B,再烘干,稱量得10g,則CaCl2溶液中溶質的質量分數為多少?________.
解:(1)在氧氣和二氧化硫的混合氣體中,其中氧元素的質量分數為60%,則硫元素的質量分數為:1-60%=40%,設混合氣體的質量為100g,則硫元素的質量為100g×40%=40g,故二氧化硫的質量為:

=80g,故氧氣的質量為100g-80g=20g,故氧氣和二氧化硫的質量比為:20g:80g=1:4,混合氣體中二氧化硫的質量分數為:
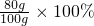
=80%,故填:1:4,80%;
(2)①A能與氯化鈣反應生成白色沉淀和氯化鈉,則A是碳酸鈉,B是碳酸鈣,故填:Na
2CO
3;
②設氯化鈣的質量為x
Na
2CO
3+CaCl
2═CaCO
3↓+2NaCl
111 100
x 10g

x=11.1g
則CaCl
2溶液中溶質的質量分數為:
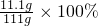
=10%
故填:10%.
分析:根據題干提供的數據結合質量守恒定律進行分析,氧氣和二氧化硫的混合氣體中含有氧元素和硫元素,根據已有的化學反應進行解答即可.
點評:本題考查了根據化學方程式的計算以及根據化學式的計算,完成此題,可以依據已有的知識結合題干提供的信息進行.

 =80g,故氧氣的質量為100g-80g=20g,故氧氣和二氧化硫的質量比為:20g:80g=1:4,混合氣體中二氧化硫的質量分數為:
=80g,故氧氣的質量為100g-80g=20g,故氧氣和二氧化硫的質量比為:20g:80g=1:4,混合氣體中二氧化硫的質量分數為: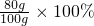 =80%,故填:1:4,80%;
=80%,故填:1:4,80%; x=11.1g
x=11.1g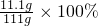 =10%
=10%

 閱讀快車系列答案
閱讀快車系列答案 某課外小組研究“影響H2O2 生成O2快慢的因素”的課題.通過查閱資料,他們提出如下猜想.
某課外小組研究“影響H2O2 生成O2快慢的因素”的課題.通過查閱資料,他們提出如下猜想. 某化學興趣小組在老師指導下,進行了“H2O2生成O2的快慢與什么因素有關”的實驗.請你幫助回答下列問題.(實驗均在20℃室溫下進行)
某化學興趣小組在老師指導下,進行了“H2O2生成O2的快慢與什么因素有關”的實驗.請你幫助回答下列問題.(實驗均在20℃室溫下進行)