
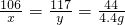
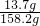 ×100%=8.7%?
×100%=8.7%?

 黃岡天天練口算題卡系列答案
黃岡天天練口算題卡系列答案科目:初中化學 來源: 題型:
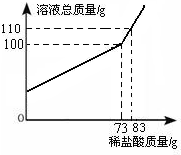 某純堿樣品中含少量氯化鈉,稱取11g樣品于燒杯中,加20.4g水將其溶解,然后逐滴加入一定質量分數的稀鹽酸并不斷振蕩,實驗過程中,測得加入稀鹽酸的質量和溶液總質量的關系如圖所示.請你解決下列問題:
某純堿樣品中含少量氯化鈉,稱取11g樣品于燒杯中,加20.4g水將其溶解,然后逐滴加入一定質量分數的稀鹽酸并不斷振蕩,實驗過程中,測得加入稀鹽酸的質量和溶液總質量的關系如圖所示.請你解決下列問題:查看答案和解析>>
科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源: 題型:
| 時間/分鐘 | t1 | t2 | t3 | t4 | t5 |
| 體積/L | 1.52 | 2.54 | 3.05 | 3.35 | 3.35 |
查看答案和解析>>
科目:初中化學 來源:2010年江蘇省無錫市蠡園中學中考化學二模試卷(解析版) 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com