
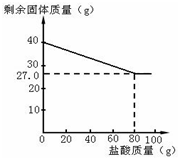
 某化學興趣小組的同學為測定假黃金(銅鋅合金)中各組成元素的質量分數,稱取40克假黃金置于燒杯中,用某濃度的稀鹽酸100克,分5次加入,每次充分反應后,取出固體,經過濾、干燥等操作后稱重,各次稀鹽酸用量和剩余固體質量記錄如下:
某化學興趣小組的同學為測定假黃金(銅鋅合金)中各組成元素的質量分數,稱取40克假黃金置于燒杯中,用某濃度的稀鹽酸100克,分5次加入,每次充分反應后,取出固體,經過濾、干燥等操作后稱重,各次稀鹽酸用量和剩余固體質量記錄如下:| 實驗次數 | 稀鹽酸的用量(g) | 剩余固體的質量(g) |
| 1 | 20 | 36.75 |
| 2 | 20 | 33.50 |
| 3 | 20 | 30.25 |
| 4 | 20 | 27.00 |
| 5 | 20 | 27.00 |
分析 (1)由曲線圖可知,加入80g鹽酸后恰好完全反應,剩余27.00g銅,根據銅的質量和假黃金的質量來計算合金與鹽酸的質量比;
(2)剩余固體是銅,根據銅的質量和假黃金的質量可以計算出合金中鋅的質量分數;
(3)由鋅和完全反應時鹽酸的質量根據鋅與鹽酸反應的化學方程式可以計算出稀鹽酸中溶質的質量分數和生成氯化鋅、氫氣的質量.
解答 解:(1)由曲線圖可知,加入80g鹽酸后恰好完全反應,剩余27.00g銅,此時合金與稀鹽酸的質量比=40:80=1:2,所以當所用合金與稀鹽酸的質量比為1:2時,表明鋅恰好完全溶解;
(2)鋅和鹽酸反應,而銅和鹽酸不反應,加入過量鹽酸后,剩余固體為銅,銅的質量為27.00g;鋅的質量=40g-27.00g=13g,故合金中鋅的質量分數為$\frac{13}{40}$×100%=32.5%
(3)設3.25g鋅與質量為x的氯化氫恰好完全反應.
Zn+2HCl=ZnCl2+H2↑
65 73
3.25g x
$\frac{65}{73}=\frac{3.25g}{x}$,x=3.65g,故稀鹽酸的質量分數=$\frac{3.65g}{20g}$×100%=18.25%
答:(1)從圖可知,當所用合金與稀鹽酸的質量比為1:2時,表明鋅恰好完全溶解.
(2)合金中鋅的質量分數為32.5%.
(3)稀鹽酸中溶質的質量分數為18.25%
點評 本題主要考查學生利用化學方程式和溶質質量分數公式進行計算的能力,解題時要知道銅與稀鹽酸不反應,銅鋅合金與稀鹽酸的反應,為鋅與稀鹽酸的反應,然后根據化學方程式進行計算,問題即可迎刃而解.


 名校課堂系列答案
名校課堂系列答案科目:初中化學 來源: 題型:選擇題
| A. | 紫色石蕊試液 | B. | 二氧化碳氣體 | C. | 碳酸鈉溶液 | D. | 氯化鋇溶液 |
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
 如圖表示了x、y、z事物間的從屬關系,下列選項中不符合圖中事物間從屬關系的是( )
如圖表示了x、y、z事物間的從屬關系,下列選項中不符合圖中事物間從屬關系的是( )| X | Y | Z | |
| A | 氧化物 | 化合物 | 純凈物 |
| B | 基因 | DNA | 染色體 |
| C | 中和反應 | 復分解反應 | 氧化還原反應 |
| D | 質子 | 原子核 | 原子 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com