3.燒堿的用途很廣,工業上制得的燒堿中常含有雜質碳酸鈉,某化學興趣小組同學對購買的燒堿成分和純度測定展開了討論與探究.
(1)為檢驗燒堿中是否含有碳酸鈉,同學們提出不同方案.
方案一:配成溶液,向其中滴加酚酞試液.同學們認為該方法無法檢驗,原因是兩種溶液都呈堿性.
方案二,配成溶液,向其中慢慢滴加稀鹽酸,大家發現,剛開始滴加時無氣泡產生,原因是NaOH+HCl=NaCl+H
2O (用化學方程式表示).
方案三:配成溶液,向其中滴加一種鹽的溶液,可以證明含有碳酸鈉,該溶液是BaCl
2、(或CaCl
2、Ca(NO
3)
2等).
(2)測定燒堿的純度
實驗原理:利用Na
2CO
3與稀H
2SO
4反應產生CO
2,通過測定CO
2的質量,確定樣品中碳酸鈉的質量,從而計算樣品的純度.
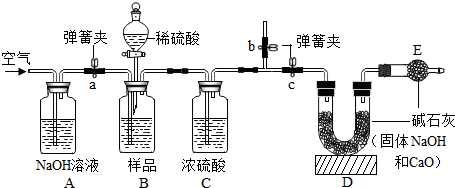
①學們根據實驗原理,設計了如圖的實驗(固定裝置省略),裝置A的作用是除去空氣中的CO
2.
②B裝置中樣品在與稀硫酸反應前和停止反應后,都要通入過量的空氣.反應前通空氣的目的是排出裝置中的CO
2.停止反應后,若不再通入空氣,則測得工業燒堿的純度將偏高(填“偏高”“偏低”或“無影響”).
③若撤去C裝置,則測得工業燒堿的純度將偏低(填“偏高”“偏低”或“無影響”).
④D、E中都放入堿石灰,其中,E中堿石灰的作用是防止空氣中的水和二氧化碳進入D裝置.
⑤現取50克樣品,按照圖中正確的實驗方法測定,待無氣泡產生時,稱得C裝置增重0.6克,D裝置增重2.2克,試通過計算,推測樣品中燒堿的純度?(有計算過程,精確到0.1%)
⑥反思:若用上面的燒堿配制氫氧化鈉溶液,需除去其中的碳酸鈉,除去的方法很多,比如,向該樣品配制的溶液中加入適量Ca(OH)
2 溶液,過濾,即得到氫氧化鈉溶液.


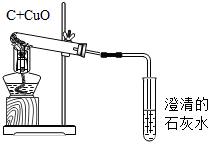 根據如圖回答下列問題;
根據如圖回答下列問題;