
分析 (1)根據常見的處理問題的方法來解決,其中進行實驗是我們首選的方法,也是最可信的方法;根據濃鹽酸的性質設計實驗;
(2)①鹽酸與氫氧化鈉反應無明顯現象,若不用指示劑的話,將不知道什么時候恰好完全反應;
③若不攪拌,鹽酸與氫氧化鈉混合不均勻,不能充分反應;
④要確定每毫升鹽酸中含溶質HCl的質量,所用鹽酸中溶質的質量根據氫氧化鈉的質量可以算出,所用鹽酸溶液的量不知道,可用所取鹽酸的量-剩余鹽酸的量得到,所以這里記錄的是剩余鹽酸的量.
(3)根據酸的通性,酸除了能與堿反應外還能與酸堿指示劑、活潑金屬、金屬氧化物、鹽反應.涉及有關酸的質量的計算,可從酸與活潑金屬反應、酸與金屬氧化物反應、酸與鹽的反應來考慮.
解答 解:(1)根據題給的四個選項可以知道,用實驗的方法可以判斷是否為濃鹽酸,由于濃鹽酸具有揮發性,所以可以打開瓶塞觀察是否產生了白霧即可;故填:C;打開瓶塞,若瓶口有白霧冒出的是濃鹽酸,否則不是濃鹽酸;
(2)①向氫氧化鈉溶液中滴加酚酞試液,溶液變為紅色,再向該溶液中滴加鹽酸,當溶液由紅色恰好變為無色時,溶液顯中性,此時氫氧化鈉與鹽酸恰好完全反應;
故填:為了指示NaOH與HCl什么時候恰好完全中和;
③用玻璃棒攪拌可以讓鹽酸與氫氧化鈉混合均勻,使其充分反應;故填:攪拌;使反應物混合均勻,充分反應;全部滴回量筒中;
④這里記錄的是量筒中剩余鹽酸的量,從而確定所用鹽酸的量;故填:量筒中剩下鹽酸的體積;
(3)一定量的酸與足量的活潑金屬反應,根據生成氫氣的質量或參加反應的金屬的質量可算出酸溶液中溶質的質量.
一定量的酸與足量的金屬氧化物反應,根據參加反應的金屬氧化物的質量可算出酸溶液中溶質的質量.
一定量的酸與足量的碳酸鹽反應,根據生成的二氧化碳的質量或參加反應的碳酸鹽的質量可求出酸溶液中溶質的質量.
故填:①用一定質量鋅粒(或鐵、鎂等活潑金屬)與鹽酸反應,測量用去鹽酸的體積;
②用一定質量碳酸鈣(或其他碳酸鹽、酸式碳酸鹽)與鹽酸反應,測量用去鹽酸的體積;
③用一定質量CuO(或其他不溶性堿性氧化物)與鹽酸反應,測量用去鹽酸的體積;
(4)根據設計的方法,判斷實驗時所需的器材即可.
故填:方法①或②或③;燒杯、量筒、膠頭滴管、玻璃棒;或燒杯、量筒、膠頭滴管、玻璃棒;或燒杯、量筒、膠頭滴管、玻璃棒.
點評 此題是一道實驗設計題,解題的關鍵是對實驗原理以及相關計算的掌握,解決此題對訓練學生相關的嚴密思維有一定好處.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:初中化學 來源: 題型:選擇題
 提起地溝油事件,我們無不痛心疾首.地溝油中含有很多有毒、有害的物質,其中的黃曲霉素Gl(C17H1207)就是一種致癌物質,下列對于黃曲霉素Gl的認識正確的是( )
提起地溝油事件,我們無不痛心疾首.地溝油中含有很多有毒、有害的物質,其中的黃曲霉素Gl(C17H1207)就是一種致癌物質,下列對于黃曲霉素Gl的認識正確的是( )| A. | 黃曲霉素Gl由碳、氫、氧三個元素構成 | |
| B. | 黃曲霉素Gl屬于有機高分子化合物 | |
| C. | 每個黃曲霉素Gl分子中的質子數和電子數相等 | |
| D. | 黃曲霉素Gl中碳元素質量分數最小 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | NH4Cl | B. | CO(NH2)2 | C. | KCl | D. | KNO3 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
 某化學課外小組的同學,在實驗室實驗時發現一瓶標簽破損的無色溶液(如圖),這瓶溶液是什么物質?在老師的指導下,同學們首先提出假設并進行了如下的探究活動.請在空白處完成相應內容.
某化學課外小組的同學,在實驗室實驗時發現一瓶標簽破損的無色溶液(如圖),這瓶溶液是什么物質?在老師的指導下,同學們首先提出假設并進行了如下的探究活動.請在空白處完成相應內容.查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
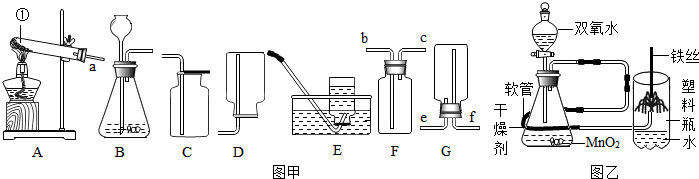
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com