52克大理石加入到足量的稀鹽酸中充分反應(yīng)后剩余固體質(zhì)量為2克(雜志不參加反應(yīng)也不溶于水)
(1)求大理石中碳酸鈣的質(zhì)量分?jǐn)?shù)(結(jié)果保留到0.1%)
(2)可產(chǎn)生多少克二氧化碳?
【答案】
分析:(1)由于大理石的主要成分是碳酸鈣,而碳酸鈣能與稀鹽酸反應(yīng)生成二氧化碳,故剩余固體即為雜質(zhì),所以可得碳酸鈣的質(zhì)量,從而可得大理石中碳酸鈣的質(zhì)量分?jǐn)?shù);
(2)利用碳酸鈣的質(zhì)量根據(jù)該反應(yīng)方程式可以求出二氧化碳的質(zhì)量;
解答:解:(1)由于碳酸鈣能與稀鹽酸反應(yīng)生成二氧化碳,故剩余固體即為雜質(zhì),所以可得碳酸鈣的質(zhì)量為52g-2g=50g,則大理石中碳酸鈣的質(zhì)量分?jǐn)?shù)為
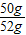
×100%≈96.2%;
(2)設(shè)可產(chǎn)生二氧化碳的質(zhì)量是x
CaCO
3+2HCl═CaCl
2+CO
2↑+H
2O
100 44
50g x

x=22g
答:(1)大理石中碳酸鈣的質(zhì)量分?jǐn)?shù)為96.2%;(2)可產(chǎn)生22克二氧化碳;
點評:本題主要考查學(xué)生運用化學(xué)方程式和質(zhì)量分?jǐn)?shù)公式綜合分析和解決實際問題的能力.增加了學(xué)生分析問題的思維跨度,強調(diào)了學(xué)生整合知識的能力.

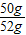 ×100%≈96.2%;
×100%≈96.2%;


 教材全解字詞句篇系列答案
教材全解字詞句篇系列答案